定性分析实验流程

定性分析综合实验方案
一、实验目的
1、用所学元素及化合物的基本知识,进行阳离子的分离和鉴别;
2、进一步培养观察实验和分析现象中所遇到的问题的能力。
二、实验原理
常见的阳离子有24种,进行离子鉴定的时候首先需要要对它们分组,然后采用化学分析方法进行鉴定。应用最为广泛的硫化氢系统是目前较为完善的一种分组方法,主要依据各离子硫化物溶解度的显著差异,将阳离子分成5组。
三、实验方案
1、试液的外表观察和准备
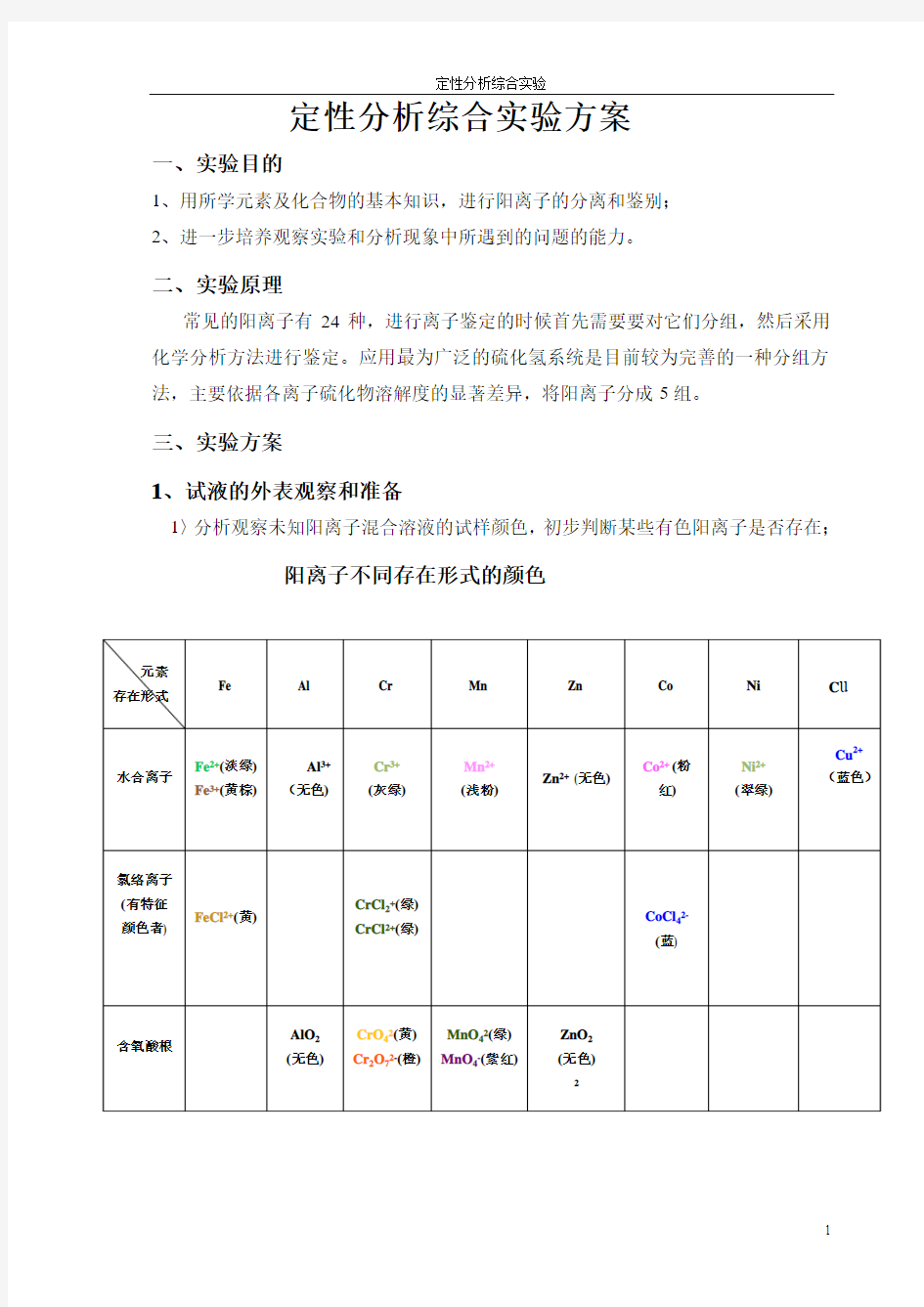
1〉分析观察未知阳离子混合溶液的试样颜色,初步判断某些有色阳离子是否存在;
阳离子不同存在形式的颜色
2 〉测量溶液的pH,消去在该pH条件下可生成沉淀的离子:
AsO33+是用碱配制的,不容易与其它离子共存,故不放。
Sn2+,4+、Sb3+,5+是用盐酸配制的
其他离子是用硝酸盐配制的
其中Al和Zn不易被检测,故不放。
2、阳离子分析
有些离子需要在原始溶液中检测。如NH4+、Fe2+、Fe3+等。
一些离子(如Fe2+、Fe3+、Mn2+、NH4+等)具有特效性的检出方法,可在其它离子共存的情况下不经分离直接从样品中检出。
其他离子依次用HCl、TAA、(NH4)2S等组试剂进行试验,依次检测未知试样中有哪些离子。但反应灵敏度较低的阳离子不能消去(可能浓度较低),以免漏检;需用其他方法验证。
3、组试剂检测
把试液分成四份,取其中的的一份进行鉴定。
鉴定NH4+
取试液少量,在试液中加浓NaOH,水浴上加热,观察湿润红色石蕊试纸是否变色。如果变蓝,示有NH4+。
鉴定Fe2+
在点滴板上滴加一滴试液,加3mol.l-1HCl、K3Fe(CN)3,若有深蓝色KFe[Fe(CN)6]沉淀,则表明有Fe2+。
鉴定Fe3+
在点滴板上滴加一滴试液,滴加NH4SCN和0.1mol.l-1 HCl,若显红色,则有Fe3+。
混合式样中阳离子组试剂的鉴定
中和至酸性
调节酸度为0.6mol ? L-1 HCl TAA,加热
稀释一倍,TAA ,加热
四、实验过程
1.观察溶液颜色,深蓝色,无任何沉淀。
将原溶液分成四份,以便分析时用。
检测PH为酸性。
2.初检
鉴定NH4+
取试液少量于下部表皿,上部表皿贴以湿润红色石蕊试纸。在试液中加浓NaOH,水浴上加热,湿润红色石蕊试纸不变色。无NH4+。
鉴定Fe3+
在点滴板上滴加一滴试液,滴加NH4SCN和0.1mol.l-1 HCl,显红色,则有Fe3+。
鉴定Mn2+
在点滴板上滴加一滴试液,加6mol/LHNO31滴,NaBiO3 粉末少许,搅拌,溶液没有呈紫红色,无Mn2+。
3.综合分析
中和至酸性
调节酸度为0.6mol? L-1 HCl TAA,加热
稀释一倍,TAA,加热
Fe
加热
NaNO 2或KCLO 3
镁试剂
NaOH
五、问题讨论
1.Sn 2+,4+、Sb 3+,5+是用盐酸配制的,可不可以与第一组阳离子共存? 答:可以,如果酸度比较高,第一组阳离子也是可以溶解的。
2.沉淀第二组硫化物时,在调节酸度上发生了偏高或偏低现象,将会引起哪些后果? 答:沉淀本组硫化物,若酸度偏低时,第三组阳离子Zn 2+ 将生成ZnS 沉淀进入第二组。若酸度偏高时,本组的Cd 2+ 不生成硫化物沉淀而进入第三组。
3.沉淀第一组阳离子为什么要在酸性溶液中进行?若在碱性条件下进行,将会发生什么后果?
答:在系统分析中,为了防止易水解离子的水解生成沉淀而进入第一组,所以沉淀
第一组阳离子时要在酸性溶液中进行。若在碱性条件下进行,第一组以后的大部分阳离子将生成沉淀,这样就不到分离的目的。
4.在系统分析中,沉淀第三组离子时可否用Na2S代替(NH4)2S?
答:在系统分析中不能用Na2S代替(NH4)2S ,因前者的碱性比后者的碱性强。若pH=10.7时第四组可能有的的Mg2+就要沉淀进入本组沉淀中。
5.以镁试剂鉴定Mg2+时,在以(NH4)2S消除干扰离子的手续中,如果加得不足,将产生什么后果?
答:以镁试剂鉴定镁时,许多重金属离子有干扰,要加入(NH4)2S以消除,若加入量不足,干扰离子除不完全,它们在碱性溶液中生成氢氧化物沉淀,这些沉淀由于本身的颜色或者由于吸附试剂而显色等而对鉴定Mg2+造成干扰。
原子吸收光谱实验报告
一、基本原理 1.原子吸收光谱的产生 众所周知,任何元素的原子都是由原子核和绕核运动的电子组成,原子核外电子按其能量的高低分层分布而形成不同的能级。因此,一个原子核可以具有多种能级状态。能量最低的能级状态称为基态能级(E 0=0),其余能级称为激发态能级,而能最低的激发态则称为第一激发态。正常情况下,原子处于基态,核外电子在各自能量最低的轨道上运动。如果将一定外界能量如光能提供给该基态原子,当外界光能量E 恰好等于该基态原子中基态和某一较高能级之间的能级差△E 时,该原子将吸收这一特征波长的光,外层电子由基态跃迁到相应的激发态,而产生原子吸收光谱。电子跃迁到较高能级以后处于激发态,但激发态电子是不稳定的,大约经过10-8秒以后,激发态电子将返回基态或其它较低能级,并将电子跃迁时所吸收的能量以光的形式释放出去,这个过程称原子发射光谱。可见原子吸收光谱过程吸收辐射能量,而原子发射光谱过程则释放辐射能量。核外电子从基态跃迁至第一激发态所吸收的谱线称为共振吸收线,简称共振线。电子从第一激发态返回基态时所发射的谱线称为第一共振发射线。由于基态与第一激发态之间的能级差最小,电子跃迁几率最大,故共振吸收线最易产生。对多数元素来讲,它是所有吸收线中最灵敏的,在原子吸收光谱分析中通常以共振线为吸收线。 2.原子吸收光谱分析原理 2.1谱线变宽及其原因 原子吸收光谱分析的波长区域在近紫外区。其分析原理是将光源辐射出的待测元素的特征光谱通过样品的蒸汽中被待测元素的基态原子吸收后,测定发射光谱被减弱的程度,进而求得样品中待测元素的含量,它符合吸收定律: ()0k l I I e νν-= (1.1) 0log 0.434I K l A I ν ν=-=- (1.2) 其中:K v 为一定频率的光吸收系数,K v 不是常数,而是与谱线频率或波长有关,I v 为透射光强度,I 0为发射光强度。
2017X射线衍射及物相分析实验报告写法
请将以下内容手写或打印在中原工学院实验报告纸上。 实验报告内容:文中红体字部分请删除后补上自己写的内容班级学号姓名 综合实验X射线衍射仪的使用及物相分析 实验时间,地点 一、实验目的 1.了解x射线衍射仪的构造及使用方法; 2.熟悉x射线衍射仪对样品制备的要求; 3.学会对x射线衍射仪的衍射结果进行简单物相分析。 二、实验原理 (X射线衍射及物相分析原理分别见《材料现代分析方法》第一、二、三、五章。)三、实验设备 Ultima IV型变温全自动组合粉末多晶X射线衍射仪。 (以下为参考内容) X衍射仪由X射线发生器、测角仪、记录仪等几部分组成。
图1 热电子密封式X射线管的示意图 图1是目前常用的热电子密封式X射线管的示意图。阴极由钨丝绕成螺线形,工作时通电至白热状态。由于阴阳极间有几十千伏的电压,故热电子以高速撞击阳极靶面。为防止灯丝氧化并保证电子流稳定,管内抽成1.33×10-9~1.33×10-11的高真空。为使电子束集中,在灯丝外设有聚焦罩。阳极靶由熔点高、导热性好的铜制成,靶面上被一层纯金属。常用的金属材料有Cr,Fe,Co,Ni,Cu,Mo,W等。当高速电子撞击阳极靶面时,便有部分动能转化为X射线,但其中约有99%将转变为热。为了保护阳极靶面,管子工作时需强制冷却。为了使用流水冷却和操作者的安全,应使X射线管的阳极接地,而阴极则由高压电缆加上负高压。x射线管有相当厚的金属管套,使X射线只能从窗口射出。窗口由吸收系数较低的Be片制成。结构分析用X射线管通常有四个对称的窗口,靶面上被电子袭击的范围称为焦点,它是发射X射线的源泉。用螺线形灯丝时,焦点的形状为长方形(面积常为1mm×10mm),此称为实际焦点。窗口位置的设计,使得射出的X射线与靶面成60角(图2),从长方形的短边上的窗口所看到的焦点为1mm2正方形,称点焦点,在长边方向看则得到线焦点。一般的照相多采用点焦点,而线焦点则多用在衍射仪上。 图2 在与靶面成60角的方向上接收X射线束的示意图 自动化衍射仪采用微计算机进行程序的自动控制。图3为日本生产的Ultima IV型变温全自动组合粉末多晶X射线衍射仪工作原理方框图。入射X射线经狭缝照射到多晶试样上,衍射线的单色化可借助于滤波片或单色器。衍射线被探测器所接收,电脉冲经放大后进人脉冲高度分析器。信号脉冲可送至计数率仪,并在记录仪上画出衍射图。脉冲亦可送至计数器(以往称为定标器),经徽处理机进行寻峰、计算峰积分强度或宽度、扣除背底等处理,并在屏幕上显示或通过打印机将所需的图形或数据输出。控制衍射仪的专用微机可通过带编码器的步进电机控制试样(θ)及探测器(2θ)进行连续扫描、阶梯扫描,连动或分别动作等等。目前,衍射仪都配备计算机数据处理系统,使衍射仪的功能进一步扩展,自动化水平更加提高。衍射仪目前已具有采集衍射资料,处理图形数据,查找管理文件以及自动进行物相定性分析等功能。 物相定性分析是X射线衍射分析中最常用的一项测试,衍射仪可自动完成这一过程。首先,仪器按所给定的条件进行衍射数据自动采集,接着进行寻峰处理并自动启动程序。
紫外光谱分析实验数据处理部分
【实验数据处理部分】 一.由实验测得的数据可以得到以下几个谱图: 1.苯蒸气的紫外吸收光谱: 左图中,苯的K吸 收带大约在214nm处, B吸收带在256nm左右。 并且,苯蒸气的精细结 构(主要指苯分子的振 动能级)清晰可见。 另外,由于滴加到 比色皿中的苯过多导致 浓度偏大,A值偏大。 (超过了1.0)。 2.不同取代基对苯的紫外吸收带的影响: (1)、苯甲酸与苯乙烯: 左图中,①②标示的 是苯蒸气的K带和B带; ③表示的是苯甲酸的K 吸收带;而④⑤表示的是 苯乙烯的E2带和K带。 (其中为了使谱图便于 比对,将苯蒸气的吸光度 值成比例地缩小了一定 的数值。) 读图可知: 与苯比较,羧基(吸 电子基)取代的苯环,其K 吸收带发生了红移,B吸 收带也有一定程度的红 移,但强度变弱了; 而对于苯乙烯,由于乙烯基双键的存在,增大了苯环的共轭体系,使得价电子跃迁所需要的能量变低,因而发生了很大程度的红移,E2带和K带分别红移至210nm和245nm处。 (2)、苯酚和苯胺:
图中,①②标示的是 苯蒸气的K带和B带; ③④表示的是苯酚的K 吸收带和B吸收带;而 ⑤⑥⑦则表示苯胺的E2 带、K带和B带。 读图可知: 苯酚的E2吸收带与 K吸收带合并了,原因是 酚羟基的助色作用使得 吸收带发生红移,同样 地,与苯相比,苯酚的B 吸收带也发生了红移; 苯胺的氮原子上含 有孤对电子,也和酚羟基一样具有助色效应,因此苯胺的各个吸收带也发生了一定程度的红移(相比较于苯而言)。 二、溶液性质对取代苯紫外吸收的影响: 1.苯酚与其碱性溶液: 图中:①②③分别标 示的是苯酚在碱性溶液 中的E2吸收带、K吸收 带和B吸收带的大致位 置;而④⑤则分别标示苯 酚在中性溶液中的K吸 收带和B吸收带的位置。 读图可知: 由于碱性溶液中的 酚羟基以氧负离子形式 存在,使得酚羟基的助色 作用大大增强,因而苯环 的吸收带均发生较大的 红移。 例如:原本在苯酚的 紫外吸收图谱中未能读出的E1、E2吸收带,此时可以大致从图中读出;另外,碱性溶液中,苯酚的K带红移至245nm左右,B带红移至290nm左右。 苯酚在碱性溶液中的变化见下图:
氢原子光谱_实验报告
氢原子光谱 摘 要:本实验用光栅光谱仪对氢原子光谱进行测量,测得了氢原子光谱巴尔末线系的波长,求出了里德伯常数。最后对本实验进行了讨论。 关键词:氢原子光谱,里德伯常数,巴尔末线系,光栅光谱仪 1. 引言 光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方法。1885年巴尔末总结了人们对氢光谱测量的结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础,对原子物理学和量子力学的发展起过重要作用。1932年尤里根据里德伯常数随原子核质量不同而变化的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素氘的存在。通过巴尔末公式求得的里德伯常数是物理学中少数几个最精确的常数之一,成为检验原子理论可靠性的标准和测量其他基本物理常数的依据。 2. 氢原子光谱 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 (1) 式中λH 为氢原子谱线在真空中的波长。 λ0=364.57nm是一经验常数。 n取3,4,5等整数。 若用波数表示,则上式变为 (2) 式中RH 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 (3) 式中M为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空 42 2 0-=n n H λλ??? ??-==22 1211~n R v H H H λ)/1()4(23202 42M m ch z me R z += πεπ
原子吸收光谱实验报告
原子吸收光谱定量分析实验报告班级:环科10-1 姓名:王强学号:2010012127 一、实验目的: 1.了解石墨炉原子吸收分光光度计的使用方法。 2.了解石墨炉原子吸收分光光度计进样方法及技术关键。 3.学会以石墨炉原子吸收分光光度法进行元素定量分析的方法。 二、实验原理: 在原子吸收分光光度分析中,火焰原子吸收和石墨炉原子吸收是目前使用最多、应用范围最广的两种方法。相对而言,前者虽然具有振作简单、重现性好等优点而得到广泛应用,但该法由于雾化效率低、火焰的稀释作用降低了基态原子浓度、基态原子在火焰的原子化区停留时间短等因素限制了测定灵敏度的提高以及样品使用量大等方面的原因,对于来源困难、鹭或数量很少的试样及固态样品的直接分析,受到很大的限制。石墨炉原子化法由于很好地克服了上述不足,近年来得到迅速的发展。 石墨炉原子吸收方法是利用电能使石墨炉中的石墨管温度上升至2000 ~ 3000 ℃的高温,从而使待测试样完全蒸发、充分的原子化,并且基态原子在原子化区停留时间长,所以灵敏度要比火焰原子吸收方法高几个数量级。样品用量也少,仅 5 ~ 100 uL。还能直接分析固体样品。该方法的缺点是干扰较多、精密度不如火焰法好、仪器较昂贵、操作较复杂等。 本实验采用标准曲线法,待测水样品用微量分液器注入,经过干
燥、灰化、原子化等过程对样品中的痕量镉进行分析。 三、仪器和试剂: 1.仪器 由北京瑞利分析仪器公司生产的WFX-120型原子吸收分光光度计。 镉元素空心阴极灯 容量瓶 50 mL(5只)微量分液器0.5 ~ 2.5 mL及5 ~ 50 uL 2.试剂 100 ng/mL镉标准溶液(1%硝酸介质) 2 mol/L硝酸溶液 四、实验步骤: 1.测定条件 分析线波长:228.8 nm 灯电流:3 mA 狭缝宽度:0.2 nm 干燥温度、时间:100℃、15 s 灰化温度、时间:400℃、10 s 原子化温度、时间:2200℃、3 s 净化温度、时间:2200℃、2 s 保护气流量:100 mL/min 2.溶液的配制 取4只50 mL容量瓶,分别加入0 mL、0.125 mL、0.250 mL、0.500 mL浓度为100 ng/mL的镉标准溶液,再各添加2.5 mL硝酸溶液(2 mol/L),然后以Milli-Q去离子水稀释至刻度,摇匀,供原子吸收测
XRD物相分析实验报告范本(完整版)
报告编号:YT-FS-1775-17 XRD物相分析实验报告范 本(完整版) After Completing The T ask According To The Original Plan, A Report Will Be Formed T o Reflect The Basic Situation Encountered, Reveal The Existing Problems And Put Forward Future Ideas. 互惠互利共同繁荣 Mutual Benefit And Common Prosperity
XRD物相分析实验报告范本(完整版) 备注:该报告书文本主要按照原定计划完成任务后形成报告,并反映遇到的基本情况、实际取得的成功和过程中取得的经验教训、揭露存在的问题以及提出今后设想。文档可根据实际情况进行修改和使用。 一、实验目的 1.掌握X 射线衍射仪的使用及进行定性相分析 的基本原理。 2.学会用PDF软件索引对多相物质进行相分析的 方法和步骤。 二、实验原理 布拉格方程:2dsinn X 射线衍射仪是按着晶体对X 射线衍射的几何 原理设计制造的衍射实验仪器。在测试过程,由X 射 线管发射出来的 X 射线照射到试样上产生衍射效应, 满足布拉格方程的2dsinn,和不消光条件的衍射光用 辐射探测器,经测量电路放大处理后,在显示或记录 装置上给出精确的衍射峰位置、强度和线形等衍射信
息,这些衍射信息可作为各种应用问题的原始数据。X 射线衍射仪的基本组成包括;X 射线发生器、衍射测角仪、辐射探测器、测量电路和控制操作、运行软件的电子计算机系统。在衍射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角,射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角,与此同时计数器沿测角仪圆运动,接收各衍射角所对应的衍射强度。任何一种结晶物质都具有特定的晶体结构。在一定波长的X 射线照射下,每种晶体物质都产生自己特有的衍射花样。每一种物质与它的衍射花样都是一一对应的,不可能有两种物质给出完全相同的衍射花样。如果试样中存在两种以上不同结构的物质时,每种物质所特有的衍射花样不变,多相试样的 衍射花样只是由它所含各物质的衍射花样机械叠加而成。在进行相分析时,只要和标准的PDF衍射图谱比较就可以确定所检测试样里面的所存在的相。 三、实验仪器,试样
实验一 紫外吸收光谱定性分析的应用
实验一紫外吸收光谱定性分析的应用 一、实验目的 1、掌握紫外吸收光谱的测绘方法。 2、学会利用吸收光谱进行未知物鉴定的方法。 3、学会杂质检出的方法。 二、基本原理 紫外吸收光谱为有机化合物的定性分析提供了有用的信息。其方法是将未知试样和标准品以相同浓度配制在相同的溶剂中,在分别测绘吸收光谱,比较二者是否一致也可将未知试样的吸收光谱与标准图谱,如萨特勒紫外吸收光谱图相比较,如果吸收光谱完全相同,则一般可以认为两者是同一种化合物。但是,有机化合物在紫外区的吸收峰较少,有时会出现不 同的结构,只要具有相同的生色团,它们的最大吸收波长 max λ相同,然而其摩尔吸光系数ε 或比吸光系数E % 1 1cm 值是有差别的。因此需利用 max λ和 max λ处的ε或E%1 1cm 等数据作进一 步比较。 在没有紫外吸收光谱峰的物质中检查含高吸光系数的杂质是紫外吸收光谱的重要用途之一。如乙醇中杂质苯的检查,只需测定256 nm处有无苯的吸收峰即可。因为在这一波段,主成分乙醇无吸收峰。 在测绘比较用的紫外吸收光谱图时,应首先对仪器的波长准确性进行检查和校正。还必须采用相同的溶剂,以排除溶剂的极性对吸收光谱的影响。同时还应注意PH值、温度等因素的影响。在实际应用时,应注意溶剂的纯度。 三、仪器与试剂 1、仪器 T6型(或其他型号)紫外可见分光光度计 1㎝石英比色皿 2、试剂 苯的乙醇溶液
1,4对苯二酚水溶液 苯甲酸的乙醇溶液 四、实验步骤 1、已知芳香族化合物标准光谱的绘制 在一定的实验条件下,以相应的溶剂作参比,用1㎝石英比色皿,在一定的波长范围内扫描(或测绘)各已知标准物质的吸收光谱作为标准光谱。 如苯甲酸的乙醇溶液的和1,4对苯二酚水溶液的标准溶液的标准光谱的绘制。 各已知芳香族化合物的标准光谱也可通过查阅有关手册得到,但应注意实验条件的一致。 2、未知芳香族化合物的鉴定 (1)称取0.100 g未知芳香族化合物,用去离子水溶解后转让100 ml容量瓶中,稀释至刻度,摇匀。实验前,稀释100倍使用。 (2)用1㎝石英比色皿,以去离子水作参比,在200-600波长范围内扫描测定未知芳香族化合物吸收光谱(如使用无扫描功能的紫外可见分光光度计测定时应首先每间隔 20 nm测量一次吸光度,然后每间隔10 nm 、5 nm 、2 nm、1 nm、0.5 nm 测量 一次吸光度。总之,越靠近吸收峰,波长间隔应越小,以得到较准确的吸收曲线)。 3、乙醇中杂质苯的检出 用1㎝石英比色皿,以乙醇作参比,在220-280 nm波长范围内扫描测定乙醇试样的吸收光谱(吸收曲线)。 五、实验结果 1、通过将未知芳香族化合物吸收光谱与已知芳香族化合物标准光谱进行比对,指出未知芳 香族化合物可能为哪种物质。 2、将乙醇试样的吸收光谱与溶解在乙醇中苯的吸收光谱进行比较,指出乙醇试样中是否有 苯存在。 六、思考题 1、配制试样溶液浓度的大小,对吸光度测量值有何影响?在实验中应如何调整? 2、对已经初步确认的化合物纯品,再设计一个实验方案,对未知物作进一步鉴定。
南京大学-氢原子光谱实验报告
氢原子光谱 一.实验目的 1.熟悉光栅光谱仪的性能和用法 2.用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数 二.实验原理 氢原子光谱是最简单、最典型的原子光谱。用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式 2 024 H n n λλ=- (1) 式中H λ为氢原子谱线在真空中的波长。0364.57nm λ=是一经验常数。n 取3,4,5等整数。 若用波数表示,则上式变为 221 112H H R n νλ?? = =- ??? (2) 式中H R 称为氢的里德伯常数。 根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得 () () 242 2 3 0241/Z me Z R ch m M ππε= + (3) 式中M 为原子核质量,m 为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,0ε为真空介电常数,Z 为原子序数。 当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)
() 242 2 3 024me Z R ch ππε∞= (4) 所以 () 1/Z R R m M ∞ = + (5) 对于氢,有 () 1/H H R R m M ∞ =+ (6) 这里H M 是氢原子核的质量。 由此可知,通过实验测得氢的巴尔末线系的前几条谱线j 的波长,借助(6)式可求得氢的里德伯常数。 里德伯常数R ∞是重要的基本物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为()=10973731.56854983/R m ∞ 表1为氢的巴尔末线系的前四条波长表 表1 氢的巴尔末线系波长 值得注意的是,计算H R 和R ∞时,应该用氢谱线在真空中的波长,而实验是在空气中进行的,所以应将空气中的波长转换成真空中的波长。即1λλλ?真空空气=+,氢巴尔末线系前6条谱线的修正值如表2所示。 表2 真空—空气波长修正值
实验室安全管理制度和流程
实验室安全管理制度与流程 一.目的:规范临床实验室的安全管理。 二.适用范围:实验室和工作人员安全的一般要求,防火、用电、化学危险物品、微生物的安全要求,以保证实验室的安全运作,将事故控制在最低限度。 三.工作程序: l工作人员和实验室安全的一般要求 1.1吸烟 实验室工作区内绝对禁止吸烟。点燃的香烟是易燃液体的潜在火种;香烟、雪茄或烟斗都是传染细菌和接触毒物的途径。 1.2食物、饮料及其它 实验工作区内不得有食物、饮料及存在“手接触可能的其它物质。实验室工作区内的冰箱禁止存放食物。食物应放置在允许进食、喝水的休息区内。 1.3化妆品 实验工作区内禁止使用化妆品或进行化妆,并建议经常洗手的实验人员使用护手霜。 1.4眼睛和面部的防护
处理腐蚀性或毒性物质时,须使用安全镜其它保护眼睛和面部的防护用品。但允许面罩或工作人员在实验室的危险区内不要佩戴隐形眼镜,除非同时使用护目镜或面罩。使用、处理能够通过粘膜和皮肤感染的试剂,或有可能发生试剂溅溢的情况时,必须佩带护目镜、面罩或面具式呼吸器。 1.5服装和个人防护装备 除要求符合实验室工作需要的着装外,工作服应干净、整洁。所有人员在各一实验区内必须穿着遮盖前身的长袖隔离服或长袖长身的工作服。当工作中有危险物喷溅到身上的可能时,应使用一次性塑料围裙或防渗外罩。有时还需要佩戴其它防护装备如:手套、护目镜、披肩或面罩等。个人防护服装应定期更换以保持清洁,遇被危险物品严重污染,则应立即更换。盛放被污染的实验服和工作服,应用合适的、有标识并能防渗的包装。清洗时应用足够高的温度和足够长的时间以获得良好的去污效果。 不得在实验室内设值班床,严禁在实验室内住宿。 1.6鞋 在各工作区内,应穿舒适、防滑、软底并能保护整个脚面的鞋。在有可能发生液体溅溢的工作岗位,可加套一次性防渗漏鞋套。帆布鞋可吸收化学物品和有传染性的液体。 1.7头发和饰物 留长发的工作人员应将头发盘在脑后,佩戴帽子。以防止头发接触到被污染物和避免人体脱屑落人工作区,不得佩戴有可能被卷入机
XRD物相分析实验报告
XRD物相分析 一、实验目的 1.掌握X 射线衍射仪的使用及进行定性相分析的基本原理。 2.学会用PDF软件索引对多相物质进行相分析的方法和步骤。 二、实验原理 布拉格方程:2dsinθ=nλ X 射线衍射仪是按着晶体对 X 射线衍射的几何原理设计制造的衍射实验仪器。在测试过程,由X 射线管发射出来的 X 射线照射到试样上产生衍射效应,满足布拉格方程的2dsinθ=nλ,和不消光条件的衍射光用辐射探测器,经测量电路放大处理后,在显示或记录装置上给出精确的衍射峰位置、强度和线形等衍射信息,这些衍射信息可作为各种应用问题的原始数据。X 射线衍射仪的基本组成包括;X 射线发生器、衍射测角仪、辐射探测器、测量电路和控制操作、运行软件的电子计算机系统。在衍射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角θ,射测量时,试样绕测角仪中心轴转动,不断地改变入射线与试样表面的夹角θ,与此同时计数器沿测角仪圆运动,接收各衍射角2θ所对应的衍射强度。任何一种结晶物质都具有特定的晶体结构。 在一定波长的X 射线照射下,每种晶体物质都产生自己特有的衍射花样。每一种物质与它的衍射花样都是一一对应的,不可能有两种物质给出完全相同的衍射花样。如果试样中存在两种以上不同结构的物质时,每种物质所特有的衍射花样不变,多相试样的
衍射花样只是由它所含各物质的衍射花样机械叠加而成。在进行相分析时,只要和标准的PDF衍射图谱比较就可以确定所检测试样里面的所存在的相。 三、实验仪器,试样 XRD仪器为:Philip X’Pert diffractometer with Cu-Ka radiation source (λ=1.54056?) at 40Kv。 实验试样:Ti98Co2基的合金 四、实验条件 2θ=20-80o step size:0.05o/S 五、实验步骤 1.开总电源 2.开电脑,开循环水 3.安装试样,设置参数,并运行Xray衍射仪。 4.Xray衍射在电脑上生成数据,保存数据。 5.利用orgin软件生成Xray衍射图谱。并依次找出峰值的2θ,并 与PDF中的标准图谱相比较,比对三强线的2θ,确定试样中存在的相。 六、实验结果及分析 含Ti98Co2基试样在2θ=20-80o,step size:0.05o/S实验条件下的Xray衍射图的标定如下图:
仪器分析实验5-紫外可见光谱分析
实验五色氨酸、苯丙氨酸和酪氨酸的紫外吸收光谱分析 一、实验目的 1. 掌握紫外-可见分光光度计的工作原理和基本操作。 2. 掌握紫外-可见吸收光谱的绘制(包括导数光谱)以及定量测定方法。 3. 掌握。 4. 了解氨基酸类物质的紫外吸收光谱特点。 二、实验原理 1. 紫外-可见吸收光谱法测定蛋白质含量的基本原理 紫外-可见吸收光谱法是根据溶液中物质的分子或离子对紫外和可见光谱区辐射能的吸收来研究物质的组成和结构的方法,也称作紫外和可见吸收广度法,它包括比色分析法和紫外-可见分光光度法。 紫外-可见分光光度法属于吸收光谱法,分子中的电子总是处在某一种运动状态中,每一种状态都具有一定的能量,属于一定的能级。电子由于受到光、热、电等的激发,从一个能级转移到另一个能级,称为跃迁。当这些电子吸收了外来辐射的能量,就从一个能量较低的能级跃迁到另一个能量较高的能级。 图1 电子跃迁示意图 物质对不同波长的光线具有不同的吸收能力,如果改变通过某一吸收物质的入射光的波长,并纪录该物质在每一波长处的吸光度(A),然后以波长为横坐标,以吸光度为纵坐标作图,这样得到的谱图为该物质的吸收光谱或吸收曲线。 当一定波长的光通过某物质的溶液时,入射光强度I。与透过光强度I之比的对数与该物质的浓度c及样品池厚度b成正比。其数学表达式为: 此式为Lambert-Beer定律,是分光光度法定量分析的基础,其中A为吸光度。 由于不同物质具有不同的分子结构,对不同波长的光会产生选择性吸收,具有不同的吸收光谱,因而,我们可以利用紫外-可见吸收光谱法对物质结构进 行鉴定和进行定量分析、根据被测量物质分子对紫外-可见波段范围
激光拉曼光谱实验报告
激光拉曼光谱实验报告 摘要:本实验研究了用半导体激光器泵浦的3Nd + :4YVO 晶体并倍频后得到的532nm 激 光作为激发光源照射液体样品的4CCL 分子而得到的拉曼光谱,谱线很好地吻合了理论分析的4CCL 分子4种振动模式,且频率的实验值与标准值比误差低于2%。又利用偏振片及半波片获得与入射光偏振方向垂直及平行的出射光,确定了各振动的退偏度,分别为、、、,和标准值0和比较偏大。 关键词:拉曼散射、分子振动、退偏 一, 引言 1928年,印度物理学家拉曼()和克利希南()实验发现,当光穿过液体苯时被分子散射的光发生频率变化,这种现象称为拉曼散射。几乎与此同时,苏联物理学家兰斯别而格()和曼杰尔斯达姆()也在晶体石英样品中发现了类似现象。在散射光谱中,频率与入射光频率0υ相同的成分称为瑞利散射,频率对称分布在0υ两侧的谱线或谱带01υυ±即为拉曼光谱,其中频率较小的成分01υυ-又称为斯托克斯线,频率较大的成分01υυ+又称为反斯托克斯线。这种新的散射谱线与散射体中分子的震动和转动,或晶格的振动等有关。 拉曼效应是单色光与分子或晶体物质作用时产生的一种非弹性散射现象。拉曼谱线的数目,位移的大小,谱线的长度直接与试样分子振动或转动能级有关。因此,与红外吸收光谱类似,对拉曼光谱的研究,也可以得到有关分子振动或转动的信息。目前拉曼光谱分析技术已广泛应用于物质的鉴定,分子结构的研究谱线特征。 20世纪60年代激光的问世促进了拉曼光谱学的发展。由于激光极高的单色亮度,它很快被用到拉曼光谱中作为激发光源。而且基于新激光技术在拉曼光谱学中的使用,发展了共振拉曼、受激拉曼散射和番斯托克斯拉曼散射等新的实验技术和手段。 拉曼光谱分析技术是以拉曼效应为基础建立起来的分子结构表征技术,其信号来源于分子的振动和转动。它提供快速、简单、可重复、且更重要的是无损伤的定性定量分析,无需样品准备,样品可直接通过光纤探头或者通过玻璃、石英、和光纤测量。拉曼光谱的分析方向有定性分析、结构分析和定量分析。
常微分方程的求解与定性分析实验报告
常微分方程的求解与定 性分析实验报告 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
常微分方程的求解与定性分析实验报告 一、实验综述 1、实验目的及要求 ●归纳和学习求解常微分方程(组)的基本原理和方法; ●掌握解析、数值解法,并学会用图形观察解的形态和进行解的定性分析; ●熟悉MATLAB软件关于微分方程求解的各种命令; ●通过范例学习建立微分方程方面的数学模型以及求解全过程; ●通过该实验的学习,使学生掌握微分方程(组)求解方法(解析法、欧拉法、 梯度法、改进欧拉法等),对常微分方程的数值解法有一个初步了解,同时学会使用MATLAB软件求解微分方程的基本命令,学会建立微分方程方面的数学模型。这对于学生深入理解微分、积分的数学概念,掌握数学的分析思维方法,熟悉处理大量的工程计算问题的方法是十分必要的。 2、实验仪器、设备或软件 电脑、 二、实验过程(实验步骤、记录、数据、分析) 实验内容: 根据实验内容和步骤,完成以下实验,要求写出实验报告(实验目的→问题→数学模型→算法与编程→计算结果→分析、检验和结论) 1.求微分方程的解析解,并画出它们的图形。 y '= y + 2 x, y (0) = 1, 0< x <1; m=dsolve('Dy=y+2*x','y(0)=1','x') ezplot(m,[0 1]) m = 3*exp(x) - 2*x – 2
1.求微分方程?? ???====-+]100[0)0(;0)0(01.03t u u u u u 的数值解,要求编写求解程序。 function dy=vdp1000(t,y) dy=zeros(2,1); dy(1)=y(2); dy(2)=-y(1)+*y(1)^3; [T,Y]=ode15s('vdp1000',[0 10],[0 0]); plot(T,Y(:,1),'-') 3.Rossler 微分方程组: 当固定参数b =2,c =4时,试讨论随参数a 由小到大变化(如 a ∈(0,)而方程解的变化情况,并且画出空间曲线图形,观察空间曲线是否形成混沌状 function r=rossler(t,x) global a; global b; global c; r=[-x(2)-x(3);x(1)+a*x(2);b+x(3)*(x(1)-c)]; global a; global b; global c; b=2; c=4; t0=[0,200]; for a=0:: [t,x]=ode45('rossler',t0,[0,0,0]); subplot(1,2,1); plot(t,x(:,1),'r',t,x(:,2),'g',t,x(:,3),'b'); title('x(红色),y(绿色),z(蓝色)随t 的变化情况');xlabel('t'); subplot(1,2,2); plot3(x(:,1),x(:,2),x(:,3)) title('相图');xlabel('x');ylabel('y');zlabel('z'); pause end 结果显示: a=0: a=: a=: a=: a=:
紫外吸收光谱实验报告
利用紫外吸收光谱检查物质纯度 紫外-可见分光光度法测定水中苯酚含量 一、实验目的 1.学会使用Cary50型紫外-可见分光光度计 2.掌握紫外-可见分光光度计的定量分析方法 二、原理简介 紫外-可见吸收光谱是由分子外层电子能级跃迁产生,同时伴随着分子的振动能级和转动能级的跃迁,因此吸收光谱具有带宽。紫外-可见吸收光谱的定量分析采用朗伯-比尔定律,被测物质的紫外吸收的峰强与其浓度成正比,即: 其中A是吸光度,I、分别为透过样品后光的强度和测试光的强度,为摩尔吸光系数,b为样品厚度。 由于苯酚在酸、碱溶液中吸收波长不一致(见下式),实验选择在碱性中测试,选择测试的波长为288nm左右,取紫外-可见光谱仪波长扫描后的最大吸收波长。 Cary50是瓦里安公司的单光束紫外-可见分光光度计。仪器原理是光源发出光谱,经单色器分光,然后单色光通过样品池,达到检测器,把光信号转变成电信号,再经过信号放大、模/数转换,数据传输给计算机,由计算机软件处理。 三、仪器与溶液准备 1、Cary50型紫外-可见分光光度计 2、1cm石英比色皿一套
3、25 ml容量瓶5只,100 ml容量瓶1只,10ml移液管二支 配置250 mg/L苯酚的标准溶液:准确称取0.0250 g苯酚于250 mL烧杯中,加入去离子水20 mL使之溶解,加入0.1M NaOH 2mL,混合均匀,移入100 mL容量瓶,用去离子水稀释至刻度,摇匀。 取5只25 mL容量瓶,分别加入1.00、2.00、3.00、4.00、5.00 mL苯酚标准溶液,用去离子水稀释至刻度摇匀,作为标准溶液系列。 将溶剂,标准溶液,待测水样依此装入石英比色皿。按测试程序的提示,依次放入样品室中进行测试。 四、测试过程 1、确认样品室内无样品 2、开电脑进入Window 系统 3、点击进入Cary50 主菜单 4、双击Cary-WinUV图标 5、在Win-UV 主显示窗口下,双击所选图标“SCAN”以扫描测定吸收曲线:取上述标准系列任一溶液装进1cm石英比色皿至4/5,以装有蒸馏水的1cm石英比色皿作为空白参比,设定在220-350 nm波长范围内扫描,获得波长-吸收曲线,读取最大吸收的波长数据。 6、在Win-UV 主显示窗口下,双击图标“Concentration”进入定量分析主菜单 7、设定测试分析步骤: (l)单击Setup功能键,进入参数设置页面。在Wavelength处填入由步骤5获取的波长数据。 (2)按Cary Control 、Standards、Options、Samples、Reports、Auto store顺序,分别设置好菜单中每页的参数。按OK回到“Concentration”界面主菜单。 (3)单击View莱单,选择需要显示的内容。 例如基本选项Toolbar,buttons,Graphics,Report。 (4)单击Zero,提示“Load blank press OK to read” (放空白按OK读),放入空白蒸馏水到样品室内,按OK测试,测完取出样品。 (5)单击Start, 出现标准/样品选择页。选Selected for Analysis(选择分析的标准和样品)。此框的内容为准备分析的标准和样品。 (6)按OK进行分析测试。 依Presentstdl的提示:放入标准1然后按OK键进行读数。放标准2按OK进行读数。直到全部标准读完。 (7)出现“Present Samplel Press OK to read”提示框,根据提示,放入样品1按OK开始读样品,直到样品测完。
实验31 原子发射光谱观测分析(实验报告)
实验31(A )原子发射光谱观测分析 【实验目的】 1. 学会使用光学多通道分析器的方法 2. 通过对钠原子光谱的研究了解碱金属原子光谱的一般规律 3. 加深对碱金属原子中外层电子与原子核相互作用以及自旋与轨道运动相互作用的了解 【实验仪器】 光学多通道分析器、光学平台、汞灯、钠灯、计算机 【原理概述】 钠属碱金属原子类,碱金属原子和氢原子一样,都只有一个价电子。但在碱金属原子中除了一个价电子外,还有内封闭壳层的电子,这些内封壳层电子与原子核构成原子实。价电子是在原子核和内部电子共同组成的力场中运动。原子实作用于价电子的电场与点电荷的电场有显著的不同。特别是当价电子轨道贯穿原子实时(称贯穿轨道),这种差别就更为突出。因此,碱金属原子光谱线公式为: ()()2 22*12*2 11~l l n R n R n n R μμν--'-'=???? ??-=' 其中ν ~为光谱线的波数;R 为里德堡常数。 n '与n 分别为始态和终态的主量子数 *2n 与*1n 分别为始态和终态的有效量子数 l '与l 分别为该量子数决定之能级的轨道量子数 l ''μ与l μ分别为始态和终态的量子缺(也称量子改正数,量子亏损) 根据就的波尔理论,在电子轨道愈接近原子中心的地方,μ的数值愈大。当轨道是贯穿轨道实,μ得数值还要大些。因为这时作用在电子上的原子核的有效电荷Z eff 有很大程度的改变。在非常靠近原子核的地方,全部核电荷作用在电子上。而距离很远的,原子核被周围电子屏蔽,以致有效核电荷1→eff Z 。因此s 项的μ值最大,而对p 项来说就小一些,对于d 来说还更小,由此类推。因而量子缺μ的大小直接反映原子实作用于价电子的电场与点电荷近似偏离的大小 对于钠原子光谱分如下四个线系 主线系:s np 3~→=ν 锐线系:p ns 3~→=ν 漫线系:p nd 3~→=ν 基线系:d nf 3~→=ν
实验室测试检测流程规范
QB 实验室测试检测流程规范 编制: 审核: 批准:
实验室测试检测流程规范 1、目的 明确火乐科技投影产品进行的高温、低温、湿热、插拔寿命、按键寿命及盐雾试验等检测项目及运作流程。 2、适用范围 适用于火乐科技发展有限公司所有投影产品或供应商(包括外包工厂)提供的部件、整机等样品。 3、职责和权限 试验申请人: ?试验检测申请单提交;?试验样品准备; ?试验过程资源协助;LAB工程师: ?试验样品接收和保存;?测试检测环境搭建; ?仪器设备运行维护; ?测试检测原始数据记录;?测试检测报告编写; ?测试检测异常反馈;研发工程师 ?测试检测过程Bug分析;DQE工程师: ?试验项目申请审核; ?测试检测结果判定及反馈;?测试检测质量监督; ?测试检测报告审核; ?测试检测报告归档关闭;质量总监: ?试验项目申请审批; ?测试检测报告审批; 4、测试检测流程
5、测试检测项目
6、测试检测过程 测试执行 ?LAB工程师根据《QA LAB测试检测申请表》,执行相应的测试检测项目,并做好测试记录; ?测试检测过程中,LAB工程师发现bug异常,进行bug登记并告知很情人和研发人员,跟踪bug解决情况,及时复测,关闭bug; ?研发人员及时分析处理bug,并按要求记录bug的分析处理信息,更新bug状态,填制bug 根因;对需要其它人员参与分析处理的时候,需及时将bug分配给下一环节人员; ?DQE跟踪测试用例执行情况,了解影响测试用例执行的因素,及时跟进有关的协调、报告测试状态; ?LAB工程师根据项目的情况,选择有关的报告形式,将测试进展情况及时通报给有关各方; 回归测试 ?所有的测试检测项目完成之后,当研发人员解决完相关bug问题,重新提交试验申请时,需进行回归测试。 ?按照测试计划中对于回归测试的策略对产品进行回归测试,回归测试的用例属于测试用例的一部分或者是全部测试用例,但不能超出原先预定的测试用例的范围,回归测试所运行的用例全部通过时,进入到测试收尾阶段; 7、测试BUG管理机制 BUG严重级别及分类
常微分方程的求解与定性分析实验报告
常微分方程的求解与定性分析实验报告 一、实验综述 1、实验目的及要求 ●归纳和学习求解常微分方程(组)的基本原理和方法; ●掌握解析、数值解法,并学会用图形观察解的形态和进行解的定性分析; ●熟悉MATLAB软件关于微分方程求解的各种命令; ●通过范例学习建立微分方程方面的数学模型以及求解全过程; ●通过该实验的学习,使学生掌握微分方程(组)求解方法(解析法、欧拉法、 梯度法、改进欧拉法等),对常微分方程的数值解法有一个初步了解,同时学会使用MATLAB软件求解微分方程的基本命令,学会建立微分方程方面的数学模型。这对于学生深入理解微分、积分的数学概念,掌握数学的分析思维方法,熟悉处理大量的工程计算问题的方法是十分必要的。 2、实验仪器、设备或软件 电脑、matlab7.0 二、实验过程(实验步骤、记录、数据、分析) 实验内容: 根据实验内容和步骤,完成以下实验,要求写出实验报告(实验目的→问题→数学模型→算法与编程→计算结果→分析、检验和结论) 1.求微分方程的解析解,并画出它们的图形。 y '= y + 2 x, y (0) = 1, 0< x <1; m=dsolve('Dy=y+2*x','y(0)=1','x') ezplot(m,[0 1]) m = 3*exp(x) - 2*x – 2
0.1 0.2 0.3 0.4 0.50.6 0.7 0.8 0.9 1 11.522.533.5 4x 3 exp(x) - 2 x - 2 1.求微分方程?? ? ??====-+]100[0)0(;0)0(01.03t u u u u u 的数值解,要求编写求解程序。 function dy=vdp1000(t,y) dy=zeros(2,1); dy(1)=y(2); dy(2)=-y(1)+0.1*y(1)^3; [T,Y]=ode15s('vdp1000',[0 10],[0 0]); plot(T,Y(:,1),'-')
实验1紫外-可见吸收光谱实验报告
实验一:紫外-可见吸收光谱 一、实验目的 1.熟悉和掌握紫外-可见吸收光谱的使用方法 2.用紫外-可见吸收光谱测定某一位置样品浓度 3.定性判断和分析溶液中所含物质种类 二、实验原理 紫外吸收光谱的波长范围在200~400,可见光吸收光谱的波长在400~800,两者都属于电子能谱,两者都可以用朗伯比尔(Lamber-Beer’s Law)定律来描述 A=ε bc 其中A为吸光度;ε为光被吸收的比例系数;c为吸光物质的浓度,单位mol/L; b为吸收层厚度,单位cm 有机化合物的紫外-可 见吸收光谱,是其分子中 外层价电子跃迁的结果, 其中包括有形成单键的σ 电子、有形成双键的π电 子、有未成键的孤对n电 子。外层电子吸收紫外或 者可见辐射后,就从基态 向激发态(反键轨道)跃 迁。主要有四种跃迁,所 需能量ΔE大小顺序为 σ→σ*>n→σ*>π→π>n→π* 1、开机 打开紫外-可见分光光度计开关→开电脑→软件→联接→M(光谱方法)进行调节实验需要的参数:波长范围700-365nm 扫描速度高速;采样间隔:0.5nm 2、甲基紫的测定 (1)校准基线
将空白样品(水)放到比色槽中,点击“基线”键,进行基线校准 (2)标准曲线的测定 分别将5ug/ml、10ug/ml 、15ug/ml 、20ug/ml甲基紫溶液移入比色皿(大约2/3处),放到比色槽中,点击“开始”键,进行扫描,保存 (3)测定试样 将试样甲基紫溶液移入比色皿(大约2/3处),放到比色槽中,点击“开始” 键,进行扫描,保存 3、甲基红的测定 (1)校准基线 将空白样品(乙醇)放到比色槽中,点击“基线”键,进行基线校准 (2)测定试样 将试样甲基紫溶液移入比色皿(大约2/3处),放到比色槽中,点击“开始” 键,进行扫描,保存 四、实验结果 1.未知浓度的测定 分别测定了5μg/ml,10μg/ml,15μg/ml,20μg/ml和未知浓度的甲基紫溶液的紫外吸收光谱,紫外吸收谱图如下: 甲基紫在580nm是达到最大吸收见下表:
GC定性分析实验报告
气相色谱法对蔬菜中农药残留的定性分析 专业(班级): 姓名: 学号: 指导教师: 实验日期:2016 年 4 月 20 日
气相色谱法对蔬菜中农药残留的定性分析 一、实验目的 1. 了解气相色谱仪的基本结构、工作原理和操作技术。 2. 了解程序升温技术在气相色谱分析中的应用。 3. 了解毛细管气相色谱分析中的应用。 4. 学习利用保留值进行色谱对照的定性方法。 二、实验原理 气相色谱仪 (Gac Chromatography, GC) 是采用气体 (载气) 作为流动相的一种色谱法。当流动相携带欲分离的混合物流经固定相时,由于混合物中各组分的性质不同,与固定相作用的程度也有所不同,因而组分在两相间具有不同的分配系数,经过相当多次的分配之后,各组分在固定相中的滞留时间有长有短,从而使各组分依次流出色谱柱而得到分离。 三、实验仪器与试剂 天美G7900气相色谱仪、电子天平(METTLER AE200) 、离心机 (菲恰尔 80-2B)、KS康氏振荡器 丙酮 (分析纯)、乙酸乙酯 (分析纯)、超纯水、对硫磷标准品、甲基对硫磷标准品、三唑磷标准品、无水硫酸钠 (分析纯)、50 mL PP 离心管、10 mL PP 离心管
四、实验内容 样品处理 1. 将蔬菜切碎 (要充分粉碎),称取2 g于20 mL离心管中。 2. 加入10 mL丙酮 : 乙酸乙酯 (1 : 1) 混合液,旋紧瓶塞,振荡 2 min后,离心4 min (1500 r/min)。 3. 加入无水硫酸钠1 g,超纯水5 mL,振荡2min后,继续离心4 min (1500 r/min)。 4. 取上清液至10 mL离心管,贴好标签。 5. 上机测定前保存于4 ℃冰箱。 色谱条件 进样口温度:240 ℃ 检测器温度:250 ℃ 柱温程序:140 ℃(1 min),然后以10 ℃/min升温至200 ℃(4 min),再以15℃/min升温至280℃ (2 min) 载气 (N2) 流量:35 mL/min 进样量:1uL 五、注意事项 1. 蔬菜一定要充分切碎,越细越好。 2. 离心前一定要振荡,使其充分混匀。 3. 上清液不用完全取完,不要将下层的水层吸取上来。
