常见的腐蚀形式

腐蚀方法
表1-1 镀层的侵蚀方法总结 Table 1-1 Generalization of different methos for coating etching 方法一方法二方法三方法四方法五 去掉钢基体2%硝酸 酒精[72] / / / / 去掉Zn 层,保留 Fe-Zn、Fe-Al 浓硝酸 [73] (90%) 10vol.%硫酸[74-75] 5vol.%HCl、六 次甲基四胺[76] 100ml戊醇、10 滴HNO3(70%)[72] 1%苦味酸 [33] 去掉 Zn、Fe-Zn,保留Fe-Al 浓硝酸 (90%) [33-34,74-76] 95mlH2O、 5mlHNO3(70%)、 20gCrO3、 4gZnSO4·7H2O[77] / / / 参考文献 [1]国家中长期科学和技术发展规划纲要https://www.docsj.com/doc/986999577.html,/jrzg/ 2006-02/09/content_ 183787.htm [2]张启富,刘邦津,黄健中. 现代钢带连续热镀锌. 北京:冶金工业出版社, 2006:52 [3]Y.D. Abreu, A.D. Silva, A.Ruiz, et al., Study of zinc coatings on steel substrate attained by two different techniques. Surface and Coatings Technology, 1999,120-121:682~686 [4]骆更新.Galfan镀层及其溶剂法热镀工艺.北方交通大学学报,1999,12(5): 23~26 [5]庞建超,曹晓明,温鸣等.单镀Galfan 钢丝抹拭工艺的研究.新技术新工艺, 2006,(3):79~80 [6]高福宝.单镀Galfan合金钢丝镀层表面质量的控制与研究:[硕士学位论文]. 天津:河北工业大学,2005 [7]H.K.Balin. 热浸镀原理与工艺.北京:冶金工业出版社,1959:34 [8] B. Jeannien. Fluoride-free flux compositions for the galvanizing in aluminum-containing zinc baths [P]. EP0259385, 1992,07.24 [9] D.M. Chay et al. Low-Fuming Galvanizing Fluxes [P]. US3816188, 1974.06.11 [10] D. Lechkis, J. Zervoudis. Flux and process for hot dip galvanization [P]. US2007/0137731A1, 2007.06. 21
金属腐蚀
1、金属腐蚀过程的特点是什么?采用那些指标可以测定金属全面腐蚀的速度。 答:特点因腐蚀造成的破坏一般从金属表面开始,然后伴着腐蚀的过程进一步发展,富士破坏将扩展到金属材料的内部,并使金属的性质和组成发生改变;金属材料的表面对腐蚀过程进行有显著的影响。重量指标:就是金属因腐蚀而发生的重量变化。深度指标:指金属的厚度因腐蚀而减少的量。电流指标:以金属电化学腐蚀过程阳极过程电流密度的大小。2、双电层的类型有哪些?平衡电极电位,电极电位的氢标度的定义? 答:类型:金属离子和极性水分子之间的水花力大于金属离子与电子之间的结合力;金属离子和极性水分子之间的水化力小于金属离子与电子之间的结合力;吸附双电层。平衡电极电位:金属浸入含有同种金属离子的溶液中参与物质迁移的是同一种金属离子,当反应达到动态平衡,反映的正逆过程的电荷和物质达到平衡,这是电位为平衡电极电位;电极电位的氢标度:以标准氢电极作为参考电极而测出的相对电极电位值称为电极电位的氢标度。 3、判断金属腐蚀倾向的方法有哪几种? 答:a腐蚀反映自由能的变化△G<0则反应能自发进行△G=0则达到平衡△G>0不能自发反应b标准电极电位越负,金属越易腐蚀 4、以Fe-H2O体系为例,试述电位-PH图的应用。 答:以电位E为纵坐标,PH为横坐标,对金属—水体系中每一种可能的化学反应或电化学反应,在取定溶液中金属离子活度的条件下,将其平衡关系表现在图上,这种图叫做电位PH平衡图。应用:预测金属的腐蚀倾向;选择控制腐蚀的途径。 5、腐蚀原电池的组成及工作历程?它有那些类型。 答:组成:阴阳极、电解质溶液、电路四个部分;工作历程:阳极过程、阴极过程、电流的流动;类型:a宏观腐蚀电池:异金属解除电池、浓差电池、温差电池;b微观腐蚀电池。 6、极化作用、极极化、阴极极化的定义是什么?极化的本质是什么?极化的类型有哪几种?答:极化作用:由于通过电流而引起原电池两级的电位差减小,并因而引起电池工作电流强度降低的现象;阳极极化:当通过电流时,阳极电位向正的方向移动的现象;阴极极化:当通过电流时,阴极电位向负的方向移动的现象;极化的本质:电子迁移的速度比电极反应及有关的连续步骤完成的快;极化的类型:电化学极化、浓度极化、电阻极化。 7、发生阳极极化与阴极极化的原因是什么? 答:阳极:阳极的电化学极化:如果金属离子离开晶格进入溶液的速度比电子离开阳极表面的速度慢,则在阳极表面上就会积累较多的正电荷而使阳极电位向正方向移动;阳极的浓度极化:阳极反应产生的金属离子进入分布在阳极表面附近溶液的速度慢,就会使阳极表面附近的金属离子浓度逐渐增加;阳极的电阻极化:很多金属在特定的溶液中能在表面生成保护膜能阻碍金属离子从晶格进入溶液的过程,而使阳极电位剧烈的向正的方向移动,生成保护膜而引起的阳极极化。阴极:电化学:氧化态物质与电子结合的速度比外电路输入电子的速度慢,使得电子在阴极上积累,由于这种原因引起的电位向负的方向移动;阴极的浓度极化:氧化态物质达到阴极表面的速度落后于在阴极表面还原反应的速度,或者还原产物离开电极表面的速度缓慢,将导致电子在阴极上的积累。 8、比较实测极化曲线与理想极化曲线的不同点?极化率的定义是什么?极化图有哪些应用?怎样判断电化学腐蚀过程的控制取决于哪些方面。 答:区别:理想极化曲线是理想电极上得到的曲线,只发生一个电极反应,初始电位为平衡电极电位,实际极化曲线是实际测量得到的曲线,不只发生一个电极反应,初始电位为混合电位。极化率:电极电位随电流密度的变化率,即电极电位对于电流密度的导数。极化图的应用:用Evans极化图表示影响腐蚀电流的因素;表示腐蚀电池的控制类型。控制取决于:阴极极化控制、阳极极化控制、欧姆电阻控制。
金属腐蚀与防护
摘要:本文论述了腐蚀的产生机理,从而探讨了防腐蚀的办法。文章介绍了金属腐蚀与腐蚀机理,详细综述了形成保护层、电化学保护法、缓蚀剂法等几种常见腐蚀防护方法的原理以及在金属腐蚀与防腐中的应用和研究进展。 关键词:金属腐蚀防护 金属腐蚀的分类:根据金属腐蚀的反应机理,腐蚀可以分为电化学腐蚀和化学腐蚀。电化学腐蚀是指金属表面与离子导电的介质因发生电化学作用而产生的破坏;化学腐蚀是指金属表面与非电解质直接发生化学作用而引起的破坏。电化学腐蚀是最常见、最普遍的腐蚀,因为只要环境的介质中有水存在,金属的腐蚀就会以电化学腐蚀的形式进行。金属在各种电解质溶液,比如大气、海水和土壤等介质中所发生的腐蚀都属于电化学腐蚀.。环境中引起金属腐蚀的物质主要是氧分子和氢离子,它们分别导致金属的吸氧腐蚀和析氢腐蚀,其中又以吸氧腐蚀最为普遍。 腐蚀给人类社会带来的直接损失是巨大的。20世纪70年代前后,许多工业发达国家相继进行了比较系统的腐蚀调查工作,并发表了调查报告。结果显示,腐蚀的损蚀占全国GNP的1%到5%。这次调查是各国政府关注腐蚀的危害,也对腐蚀科学的发展起到了重要的推动作用。在此后的30年间,人们在不同程度上进行了金属的保护工作。在以后的不同时间各国又进行了不同程度的调查工作,不同时期的损失情况也是不同的。有资料记载,美国1975年的腐蚀损失为820亿美元,占国民经济总产值的4.9%;1995年为3000亿美元,占国民经济总产值的4.21%。这些数据只是与腐蚀有关的直接损失数据,间接损失数据有时是难以统计的,甚至是一个惊人的数字。我国的金属腐蚀情况也是很严重的,特别是我国对金属腐蚀的保护工作与发达的工业国家相比还有一段距离。据2003年出版的《中国腐蚀调查报告》中分析,中国石油工业的金属腐蚀损失每年约100亿人民币,汽车工业的金属腐蚀损失约为300亿人民币,化学工业的金属腐蚀损失也约为300亿人民币,这些数字都属于直接损失。如该报告中调查某火电厂锅炉酸腐蚀脆爆的实例,累计损失约15亿千瓦·时的电量,折合人民币3亿元,而由于缺少供电量所带来的间接损失还没有计算在内。所以说,金属腐蚀的损失是很严重的,必须予以高度的重视。金属腐蚀在造成经济损失的同时,也造成了资源和能源的浪费,由于所报废的设备或构件有少部分是不能再生的,可以重新也冶炼再生的部分在冶炼过程中也会耗费大量的能源。目前世界上的资源和能源日益紧张,因此由腐蚀所带来的问题不仅仅只是一个经济损失的问题了。腐蚀对金属的破坏,有时也会引发灾难性的后果,此方面的例子太多了,所以对金属腐蚀的研究是利国利民的选择。由于世界各国对于腐蚀的危害有了深刻的认识,因此利用各种技术开展了金属腐蚀学的研究,经过几十年代努力已经取得了显著的成绩。 金属防护的方法: 改善金属的本质根据不同的用途选择不同的材料组成耐蚀合金,或在金属中添加合金元素,提高其耐腐蚀性,可以防止或减缓金属的腐蚀。例如,在钢中加入镍制成不锈钢可以增强防腐蚀能力。 在金属表面形成保护层在金属表面覆盖各种保护,把被保护金属与腐蚀性介质隔开,是防止金属腐蚀的有效方法[3]。工业上普遍使用的保护层有非金属保护层和金属保护层两大类。它们是用化学方法、物理方法和电化学方法实现的。该法就是使金属表面形成转化层和加上一层坚固的保护层,达到隔离大气保护金属的目的.如对金属表面实施电镀、化学镀以及氧化、磷化处理等,可使金属表面覆盖一层耐腐蚀的保护层;也可以对金属表面氮化。
混凝土结构的腐蚀及防腐措施
混凝土结构一直被认为是一种节能、经济、用途极为广泛的人工耐久性材料,是目前应用较为广泛的结构形式之一.但随着结构物的老化和环境污染的加剧,其耐久性问题越来越引起国内外广大研究者的关注.由于勘察、设计、施工及使用过程中多因素影响,很多混凝土结构都先后出现病害和劣化,使结构出现了各种不同程度的隐患、缺陷或损伤,导致结构的安全性、适用性、耐久性降低,最终引起结构失效,造成资金的巨大浪费.从国外情况来看[1],美国与钢筋腐蚀有关的损失占总腐蚀的40%;前苏联工业建筑的腐蚀损失占工业固定资产的16%,仅混凝土和钢筋的腐蚀损失占GDP的1·25%; 1999年,澳大利亚公布的腐蚀损失为GDP 的4.2%.除此之外,北欧、英国、加拿大、印度、日本、韩国及海湾地区等不少国家都存在以基础结构设施为主的腐蚀.中国面临的问题同样很严峻.根据中国工程院2001~2003年《中国工业和自然环境腐蚀调查与对策》中的统计, 1998年中国建筑部门(包括公路、桥梁建筑)的腐蚀损失为1000亿人民币[2].近年来,中国建筑行业的发展速度突飞猛进,一批批建筑物拔地而起,但钢筋混凝土基础的耐久性问题也逐渐暴露出来.所以,重视和加强钢筋混凝土基础结构的腐蚀性与防腐措施的研究已迫在眉睫. 1 腐蚀机理分析 1·1 混凝土的腐蚀机理 混凝土的腐蚀是一个很复杂的物理的、物理化学的过程.由于混凝土腐蚀机理的复杂性,对混凝土腐蚀的分类还没达成一个共同的认识,但一般都倾向于采用前苏联学者B·M.莫斯克文为代表所提出的分类方法[3].将混凝土的腐蚀分为3类:溶蚀性腐蚀、某些盐酸溶液和镁盐的腐蚀、结晶膨胀型腐蚀. 所以,混凝土的腐蚀机理可从以下3类入手:物理作用、化学腐蚀、微生物腐蚀. 1·1·1 物理作用 物理作用是指在没有化学反应发生时,混凝土内的某些成分在各种环境因素的影响下,发生溶解或膨胀,引起混凝土强度降低,导致结构受到破坏.物理作用主要包括2类:侵蚀作用和结晶作用. (1)侵蚀作用:当环境中的侵蚀性介质(如地下软水,河流、湖泊中的流水)长期与混凝土接触时,将会使混凝土中的可溶性成分(如Ca(OH)2)溶解.在无压力水的环境下,基础周围的水容易被溶出的Ca(OH)2饱和,使溶解作用终止.侵蚀作用仅仅发生在混凝土表面,影响不大.但在
腐蚀控制的方法
腐蚀控制的方法 1. 根据使用的环境,正确地选用金属材料和非金属材料; 2. 对产品进行合理的结构设计和工艺设计,以减少产品在加工、装配、储存等环节中的腐蚀; 3. 采用各种改善腐蚀环境的措施,如在封闭或循环的体系中使用缓蚀剂,以及脱气、除氧和脱盐等; 4. 采用化学保护方法,包括阴极保护和阳极保护技术; 5. 在基材上施加保护涂层,包括金属涂层和非金属涂层。 全面腐蚀与局部腐蚀 全面腐蚀是常见的一种腐蚀。全面腐蚀是指整个金属表面均发生腐蚀,它可以是均匀的 也可以是不均匀的。全面腐蚀速度也称均匀腐蚀速度,常用的表示方法有重量法和深度法。局部腐蚀主要有点蚀(孔蚀)、缝隙腐蚀、晶间腐蚀、选择腐蚀、应力腐蚀、腐蚀疲劳、 湍流腐蚀等。 点腐蚀(孔蚀)------是一种腐蚀集中在金属(合金)表面数十微米范围内且向纵深发 展的腐蚀形式,简称点蚀。点蚀是一种典型的局部腐蚀形式,具有较大的隐患性及破坏性。点蚀表面直径等于或小于它的深度。一般只有几十微米。 点蚀发生的条件 1.表面易生成钝化膜的材料,如不锈钢、铝、铅合金;或表面镀有阴极性镀层的金属,如碳钢表面镀锡、铜镍等。 2.在有特殊离子的介质中易发生点蚀,如不锈钢在卤素离子的溶液中易发生点蚀。 3.电位大于点蚀电位(Ebr)易发生点蚀。 影响点蚀的因素及预防措施 合金成分、表面状态及介质的组成,pH 值、温度等,都是影响点蚀的主要因素。不锈钢中Cr 是最有效提高耐点蚀性能的合金元素,如与Mo、Ni、N 等合金元素配合,效果最好。降低钢中的P、S、C 等杂质含量可降低点蚀敏感性。奥氏体不锈钢经过固溶处理后耐点蚀。预防点蚀的措施:(1)加入抗点蚀的合金元素,含高Cr、Mo 或含少量N 及低C 的不锈钢抗点蚀效果最好。如双相不锈钢及超纯铁素体不锈钢。(2)电化学保护。(3)使用缓蚀剂。
耐蚀金属材料课程练习题答案(江苏科技大学)
练习题 一、选择题 1、为了提高合金的耐蚀性,向材料中加入强的阴极性元素金属,属于以下哪种 方法A。 A)降低阳极相活性B)降低阴极相活性C)增加系统阻力 2、同样加入强阴极性元素,有的合金耐腐蚀,有的却不耐蚀。其原因是A。 A)前者处于可钝化的,后者不是B)前者腐蚀体系处于常温,后者不是 C)前者腐蚀体系存有活化离子(如Cl-),后者不是D)以上都不是 3、为提高铁金属材料耐蚀性,铬是一种常添加的元素,主要起以下作用B。 A)使腐蚀电位正移,增加材料的热力学稳定性B)合金易进入钝态区 C)致钝电位向正向移动D)以上都对 4、加入Cu、P、Cr元素的耐候钢具有较好的耐大气腐蚀性,机理是D。 A)有序固溶理论B)电子机构理论 C)表面富集理论D)形成致密腐蚀产物膜理论 5、金属产生晶间腐蚀应满足的条件是C A)在高压的环境中,只要其电极电位低且强度不够; B)在高温的环境中,只要其产生的氧化膜不够致密; C)在腐蚀的环境中,只要其晶粒与晶界物-化状态和电化学性能不同; D)在高压、高温、腐蚀的环境中,只要其晶粒与晶界成分不符合塔曼定律; 6、奥氏体不锈钢中添加Nb元素的主要作用是C A)增加膜的致密性B)提高材料的抗点蚀能力 C)作为稳定化元素抑制碳化铬的生成D)增加热力学稳定性 7、黄铜脱锌属于以下哪种腐蚀类型E。 A)点蚀B)缝隙腐蚀C)晶间腐蚀D)电偶腐蚀E)选择性腐蚀 8、下列哪种热处理工艺对1Cr18Ni9Ti的抗晶间腐蚀是必须的B A)固溶处理B)稳定化处理 C)去应力退火处理D)敏化处理 9、加入了稳定化元素Ti、Nb的奥氏体不锈钢,却没有达到耐腐蚀的目的。这可能是该钢种在使用前没能进行过D处理。 A)固溶处理B)敏化处理C)退火处理D)稳定化处理 10、海水腐蚀环境中,以下哪个区域腐蚀最严重A。 A)飞溅带B)潮差带C)全浸带D)海泥带 11.以下关于可逆氢脆说法错误的是C A)氢脆在室温附近最敏感;B)材料强度越高,氢脆越敏感;
换热器的防腐蚀措施
编号:SM-ZD-43372 换热器的防腐蚀措施Through the process agreement to achieve a unified action policy for different people, so as to coordinate action, reduce blindness, and make the work orderly. 编制:____________________ 审核:____________________ 批准:____________________ 本文档下载后可任意修改
换热器的防腐蚀措施 简介:该方案资料适用于公司或组织通过合理化地制定计划,达成上下级或不同的人员之间形成统一的行动方针,明确执行目标,工作内容,执行方式,执行进度,从而使整体计划目标统一,行动协调,过程有条不紊。文档可直接下载或修改,使用时请详细阅读内容。 1.采用能耐介质腐蚀的金属和非金属材料 2.采取有效的防腐蚀措施 (1)防腐涂层 在换热器与腐蚀介质接触表面,覆盖一层耐腐蚀的涂料保护层,涂层要有较好的耐蚀性、防渗性和较好的附着力和柔韧性。对水冷系统,管内清洗干净后进行预膜处理。 (2)金属保护层 常用方法有衬里、复合板(管)、金属喷涂、金属堆焊等。
(3)电化学保护 阴极保护因费用太高,一般不用。阳极保护是接以外用电源的阳极保护换热器,金属表面生成钝化膜而得到保护。 (4)防应力腐蚀措施 ①胀接结构,其胀管率越大,残余应力越大,则在腐蚀介质中其电极电位越高,腐蚀倾向越大。在同一种腐蚀介质中,与焊接结构相比较,胀接结构,特别当胀接时胀管率较大时,更容易产生应力腐蚀,因而在保证胀接强度及密封性的条件下,胀接压力不宜过高以控制胀接后残余应力的大小,减小产生应力腐蚀的可能性。必要时可改变换热管与管板的连接形式,如用强度焊加轻微贴胀的结构代替原先的胀接结构,这种结构既减小了结构的残余应力,又能防止只焊接而产生缝隙腐蚀的可能,通过改变换热管与管板的连接形式来减小结构的残余应力,对预防换热器的应力腐蚀破裂是有效、可行的。
第五章 常见的局部腐蚀 25分
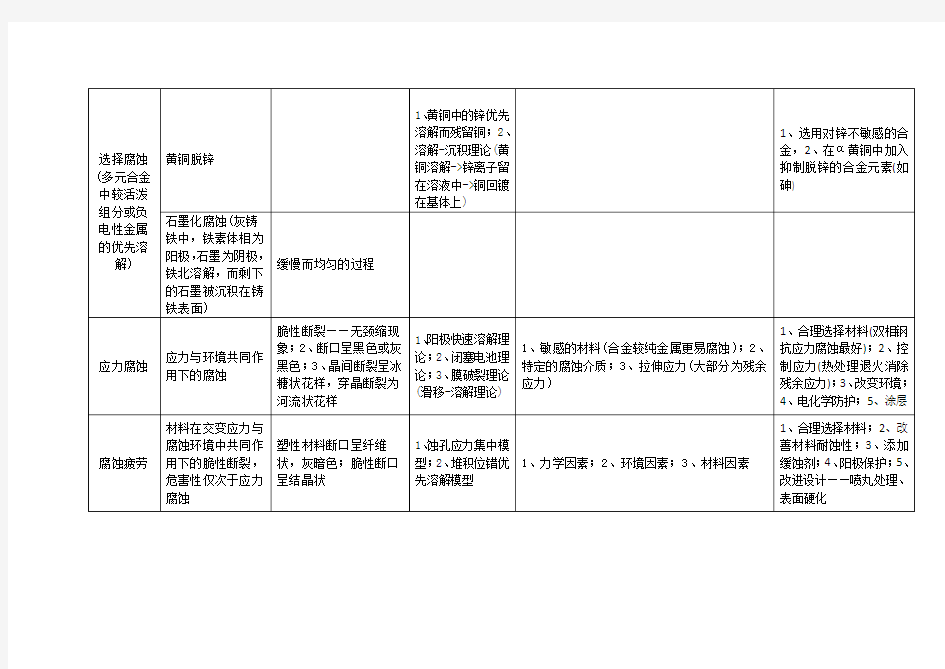
一.电偶腐蚀:异种金属在同一介质中接触,由于腐蚀电位不相等有电偶电流流动,使电位较低的金属溶解速度增加,造成接触处的局部腐蚀。而电位较高的金属,溶解速度反而减小,这就是电偶腐蚀。又称为接触腐蚀或双金属腐蚀。 实质:由两种不同的电极构成的宏观原电池的腐蚀。 差异效应:一个腐蚀的金属,由于外加阳极极化引起其内部腐蚀微电池电流改变,这种现象称为差异效应 正差异效应:外加阳极极化引起内部腐蚀微电池电流的减少。 负差异效应:外加阳极极化引起内部腐蚀微电池电流的增加。 电偶序:根据金属(或合金)在一定条件下测得的稳定电位(腐蚀电位)的相对大小排列而成的表。 影响因素:(1)面积比阴阳极面积比越大,阳极腐蚀速度越快(避免大阴极小阳极结构)(2)介质的电导率一般来说,介质的电导率高,金属的腐蚀速度加快。但对电偶腐蚀来说,介质电导率的高低对阳极金属的腐蚀程度的影响有所不同。例如:海水、软水或普通大气 控制方法:避免异金属接触避免大阴极小阳极尽可能采取绝缘处理或表面处理二.小孔腐蚀:在金属表面的局部地区,出现向深处发展的小孔,其它地区不腐蚀或腐蚀很轻微,这种腐蚀形态称为小孔腐蚀,简称孔蚀或点蚀。 小孔腐蚀的基本机理:当处于钝态的金属在含有活性阴离子介质中时,会在表面上形成孔蚀核。蚀孔内的金属表面处于活态,电位较负;蚀孔外的金属表面处于钝态,电位较正,于是孔内和孔外构成一个活态-钝态微电偶腐蚀电池,具有大阴极小阳极的结构,加速腐蚀。孔内介质相对于孔外呈滞流状态,成为贫氧区,溶解氧不易扩散过来,Cl-扩散进来以保持电中性,Cl-又可使孔内表面继续维持活态。同时氯化物水解使孔内介质酸度增加,阳极溶解加速,同时水中可溶性盐如Ca (HCO3)2转化为CaCO3沉淀,锈层与垢层一起在孔口处沉积形成一个闭塞电池,从而使得腐蚀进一步加速。这种作用成为“自闭塞酸化作用”,加速小孔腐蚀。影响孔蚀的因素:合金/金属性质:钝化能力越强,敏感性越高; 介质的性质:孔蚀的发生和介质中含有活性阴离子或氧化性阳离子有关;氯离子 浓度增加,孔蚀电位下降,孔蚀容易发生; 温度:温度上升,孔蚀加速; 流动状态:静止状态的金属的孔蚀速度 比介质处于流动状态时大。 表面状态:光滑的和清洁的表面不易发 生孔蚀。 4孔蚀的控制方法:选用耐孔蚀合金,减 少钢中硫、碳含量;尽量减少介质中活性 阴离子的浓度;加入缓蚀剂,目的增加钝 化膜的稳定性或使受损金属再钝化;进行 钝化处理(用一定浓度的酸控制温度浸 泡);采用外加阴极电流抑制孔蚀。 三.缝隙腐蚀:金属部件在介质中,由于 金属与金属或金属与非金属之间形成特 别小的缝隙,使缝隙内介质处于滞流状态, 引起缝内金属加速腐蚀,这种局部腐蚀称 为缝隙腐蚀。 基本机理:开始时,氧去极化反应在缝 内外以均匀速度进行,但随着反应的进行, 缝隙内的氧逐渐消耗,因为缝内为滞流状 态,所以缝外的氧无法扩散进来,缝内外 构成了宏观的氧浓差电池。缝内贫氧区为 阳极,发生金属溶解反应,缝外为阴极, 且构成大阴极小阳极的结构,二次产物在 缝口处形成,发展为闭塞电池。此时金属 离子难以扩散到缝外,随着缝内Fe离子 的积累,缝内正电荷过剩,促使缝外氯离 子迁移入内以保持电荷平衡。金属氯化物 的水解使缝内介质酸化,pH可下降到3 左右,因此,加速了阳极溶解,引起更多 的氯离子迁入,形成一个自催化过程,使 金属的溶解加速进行下去。 影响缝隙腐蚀的因素:金属本身:钝化 能力的高低影响缝隙腐蚀 介质:充气中性氯化物介质中发生,介质 中Cl浓度越高,发生腐蚀的可能性越大; 溶解氧的浓度大于0.5ppm时便会引起腐 蚀 温度越高,缝隙腐蚀的危害性越大 缝隙腐蚀的控制:选材:采用高钼、铬、 镍不锈钢可耐缝隙腐蚀;结构设计: 采用电化学保护法:使保护电位控制在击 穿电位和活化电位之间。 四.晶间腐蚀 腐蚀沿着金属或合金的晶粒边界或它的 邻近区域发展,晶粒本身腐蚀很轻微,这 种腐蚀称为晶间腐蚀。晶粒与晶界之间存 在一定的电位差,这主要是合金在受热不 当时,组织发生改变而引起的,所以晶间 腐蚀是一种组织电化学不均匀引起的局 部腐蚀 晶间腐蚀机理贫化理论以不锈钢的贫铬 理论为例:不锈钢在出厂前已经固溶处理, 即将钢加热到1050~1150℃后进行淬火 处理,目的是获得均相固溶体。奥氏体中 含有少量碳,碳在奥氏体中的固溶度随着 温度下降而减少,所以经固溶处理的钢, 碳是过饱和的。当钢无论是受热或冷却通 过450~850 ℃时,碳便会形成(Fe,Cr) 23 C6从奥氏体中析出分布在晶界上。(Fe, Cr)23C6的含铬量比奥氏体基体的含铬量 高很多,它的析出消耗了晶界处附近大量 的铬,而消耗的铬不能从晶粒中通过扩散 及时得到补充,结果晶界附近的含铬量低 于钝化必须的限量(12%),形成贫铬区, 因而钝态受到破坏,晶界电位下降,而晶 粒本身仍维持钝态,电位较高,晶粒与晶 界构成钝态-活化微电偶电池,电池具有 大阴极小阳极的面积比,这样就导致晶界 区的腐蚀。 晶间腐蚀的控制:重新固溶处理:稳定化 处理:加入一定量的钛和铌采用超低碳 不锈钢采用双相钢:在奥氏体中含有 10~20%铁素体的钢 五.应力腐蚀:金属材料在固定拉应力和 特定介质的共同作用下引起的破裂。简称 SCC。 六.腐蚀疲劳:金属材料在循环应力和腐 蚀介质的联合作用下,所引起的另一种腐 蚀形态。金属构件发生腐蚀疲劳时,局部 地区呈现宏观裂纹。纯机械疲劳要高于临 界循环应力值(疲劳极限)才能发生疲劳 破裂。腐蚀疲劳可以在很低的循环应力下 破裂。 七.磨损腐蚀:由于介质的运动速度大或 介质与金属构件相对运动速度大,导致构 件局部表面遭受严重的磨损,称为磨损腐 蚀,简称磨蚀。 八.选择性腐蚀:合金在腐蚀过程中,腐 蚀介质不是按合金的比例侵蚀,而是发生 了其中某种成分的选择性溶解,使合金的 机械强度下降,这种腐蚀形态称为成份选 择性腐蚀。
金属腐蚀研究报告方法
金属腐蚀研究方法 院(系):材料科学与工程学院专业班级:金材1101班 学生姓名:卢阳 学号:9 完成日期:2014年11月16日
金属腐蚀研究方法 ——缝隙腐蚀的研究 缝隙腐蚀是在电解质溶液(特别是含有卤族离子的介质)中,在金属与金属或金属与非金属表面之间狭窄的缝隙内,溶液的移动受到阻滞,当缝隙内溶液中的氧耗竭后,氯离子从缝隙外向缝隙内迁移,金属氯化物的水解酸化过程发生,导致钝化膜的破裂而产生与自催化点腐蚀相类似的局部腐蚀。缝隙腐蚀现象非常普遍,对一些耐蚀金属材料的危害尤其明显[1]。 1、缝隙腐蚀的机理[2] 缝隙腐蚀可分为初期阶段和后期阶段。在初期阶段,发生金属的溶解和阴极的氧还原为氢氧离子的反应: 阳极:M→M++e 阴极:O2+2H2O+4e→4OH- 阳极阴极此时金属和溶液之间电荷是守恒的,金属溶解产生的电子立即被氧还原消耗掉。在经过一段时间后,缝内的氧消耗完后,氧的还原反应不再进行。这时缝内缺氧,缝外富氧,形成了氧浓差电池,金属M在缝内继续溶解,缝内溶液中M+过剩,为了保持电荷平衡,缝隙外部迁移性大的阴离子(如氯离子)迁移到缝内,同时阴极过程转到缝外。缝内已形成金属的盐类(包括氯化物和硫酸盐)发生水解: M+CI+H2O→MOH↓+H+CI- 结果使缝内pH值下降,可达2至3,这就促使缝内金属溶解速度增加,相应缝外邻近表面的阴极过程,即氧的还原速度也增加,使外部表面得到阴极保护,而加速了缝内金属的腐蚀。 而Myer等人认为,至少还有氢离子、中性盐和缓蚀剂的浓差电池存在于缝隙腐蚀过程中,Brown以水解后局部酸化引起局部腐蚀的依据,提出了闭塞腐蚀电池(occluded corrosion cell)的概念。另外,Fontana和Rosefeld等人,指出了蚀孔或缝隙闭塞电池的自催化理论。 缝内外溶液的对流和扩散受阻,导致闭塞区贫氧,缝隙外仍然富氧,造成的氧浓差电池使缝隙内金属的电位低于缝隙外金属的电位,pH值的降低以及H+和Cl-的作用(HCl)使金属处于活化状态,促进闭塞区内金属的溶解,形成二次腐蚀产物Fe(OH)3在缝口,造成正电荷过剩,Cl-迁入。而氯化物在水中发生水解,使缝隙内介质(H+离浓度增加)酸化,pH值下降,因此,加速了阳极的溶解。阳极的加速溶解,又引起更多的Cl-离子迁入,氯化物浓度又增加,氯化物的水解又使介质进一步酸化,如此反复循环,形成了一个闭塞电池内的自催化效应。 2、缝隙腐蚀试验方法 在相对闭塞的狭小缝隙中存留的溶液容量甚微,因此必须设计一些特殊的研究方法
冷却水中金属腐蚀影响因素
工 业 技 术 1 影响因素:1.1 PH 值 PH=-log[H +] PH 值是溶液中氢离子浓度的负对数值,它表征溶液的微酸碱的性质,PH=7,中性;PH<7,酸性;PH>7,碱性,因为许多化学反应都是在[H +]很小的条件下进行的,为了表示很小的浓度,避免用负指数的麻烦,通常用负对数来表示酸碱度,故引入PH 值的概念。 由此可见,冷却水的PH 值越小,酸性越大,对碳钢等金属在水中的腐蚀就会快一些,反之,会慢一些。 1.2 阴离子 金属腐蚀速度与水中阴离子的种类有密切的关系,水中不同的阴离子在增加金属腐蚀速度方面的顺序为: 冷却水中金属腐蚀影响因素 程明新 贾 在 蓝树宏 张艳强 (中国石油呼和浩特石化公司,内蒙古 呼和浩特 010000) 摘 要:在冷却水系统的正常运行以及化学清洗过程中,金属常常会发生不同形态的腐蚀,根据金属腐蚀的理论知识,通过观察试样或腐蚀设备的腐蚀形态,再配合一些其他方法,人们常常找出产生腐蚀的原因和解决腐蚀的措施。关键词:冷却水;金属腐蚀;硬度;金属离子;悬浮固体中图分类号: U664.81+4 文献标识码:A NO 3- 1.1 金属的腐蚀机理 1.1.1 金属腐蚀的定义 金属及其制品在生产和使用过程中,在周围环境因素的作用下,发生破坏变质,改变了原有的化学、物理、机械等特性,称为金属腐蚀。 根据金属腐蚀过程,可以把腐蚀分为化学腐蚀和电化学腐蚀两大类。 1.1.2 化学腐蚀 化学腐蚀是金属与环境介质直接发生化学反应而产生的损伤。 特点:○1在腐蚀过程中没有电流产生,○2腐蚀产物直接产生并覆盖在发生腐蚀的地方。○3化学腐蚀往往在高湿的气体介质中发生。 钢铁在高温气体环境中很容易被腐蚀,如果同时有盐类或含硫物质存在,则会加速高温氧化,这称为热腐蚀。 1.1.3 电化学腐蚀 航空器上所发生的腐蚀大多数属于电化学腐蚀。 一、原电池 凡能将化学能转变为电能的装置称作原电池。 电化学腐蚀的最显著的特征是电化学腐蚀过程中有自由电子流动,产生电流。 二、电化学腐蚀与腐蚀电池 电化学腐蚀就是在金属上产生若干原电池(实际上是短路原电池,即称腐蚀电池),金属成为阳极,遭到溶解而发生腐蚀。 形成原电池的条件:1、两种金属(或两个区域)之间存在电位差;2、两种金属之间有导电通路;3、有腐蚀环境或腐蚀溶液。 铝合金的电化学腐蚀: 含有铜的铝合金构件处在潮湿的大气中,在其表面形成一层电解质溶液薄膜。这就构成了腐蚀电池。该腐蚀电池的阳极为电位较低的基体铝(-1.66V),阴极为电位较高的添加元素铜(+0.337V)。 电子由铝流向铜,铝遭到溶解。 根据组成腐蚀电池的大小,可以把腐蚀电池分为宏电池及微电池两类。 造成金属表面电位不同,形成微电池的原因很多,常见的有: (1)金属表面化学组成不均,夹杂有杂质。 (2)金属表面组织不均。 (3)金属表面生成氧化膜不均匀。 (4)金属表面物理状态不均匀。金属在机械加工过程中,受到拉、压、剪切作用,或由于热处理不均匀,造成不同部位表面的内应力和变形不同。通常,变形大,内应力高的地方为阳极,易受到腐蚀。 常见金属及其合金的电位: 一、Mg及其合金,铝合金5052、5056、5036、6061、6063、5356 二、Zn、Cd、除以上6种以外的铝合金 三、除不锈钢之外的碳钢、合金钢、Fe、Pb、Sn 四、Cu、Cr、Ni、Ag、Au、Pt、Ti、钴、铑、不锈钢 同一组中,电位基本一致,基本不发生电化学腐蚀;不同组中,第一组电位最低,为阳极,被腐蚀。 设备防腐蚀办法引言 防腐蚀的方法总的来说可以分为两大类:一是正确地选择防腐蚀材料和其他防腐蚀措施;二是选择合理的工艺操作及设备结构。严格遵守化工生产的工艺规程,可以消除不应当发生的腐蚀现象,而即使采用良好的耐腐蚀材料,在操作工艺上不腐蚀规程,也会引起严重的腐蚀。目前,化工生产中常用的防腐蚀方法有以下几种。 1 正确选材和设计 了解不同材料的耐蚀性能,正确地、合理地选择防腐蚀材料是最行之有效的方法。众所周知,材料的品种很多,不同材料在不同环境中的腐蚀速度也不同,选材人员应当针对某一特定环境选择腐蚀率低、价格较便宜、物理力学性能等满足设计要求的材料,以便设备获得经济、合理的使用寿命。 2 调整环境 如果能消除环境中引起腐蚀的各种因素,腐蚀就会终止或减缓,但是多数环境是无法控制的,如大气和土壤中的水分,海水中的氧等都不可能除去,且化工生产流程也不可能随意更改。但是有些局部环境是可以被调整的,如锅炉进水先去除氧(加入脱氧剂亚硫酸钠和肼等),可保护锅炉免遭腐蚀;又如空气进入密闭的仓库前先出去水分,也可避免贮存的金属部件生锈;为了防止冷却水对换热器和其他设备造成结垢和穿孔,可在水中加入碱或酸以调节PH值至最佳范围(接近中性);炼油工艺中常加碱或 氨使生产流体保持中性或碱性。温度过高时,可在器壁冷却降温,或在设备内壁砌衬耐火砖隔热,等。这些都是改变环境且不影响产品和工艺的前提下采用的方法,在允许的前提下,建议工艺中选用缓和的介质代替强腐蚀介质。 3 加入缓蚀剂 通常,在腐蚀环境中加入少量缓蚀剂就可以大大减缓金属的腐蚀,我们一般将它分为无机、有机和气相缓蚀剂三类,其缓蚀机理也各不相同。 1无机缓蚀剂 有些缓蚀剂会使阳极过程变慢,称之为阳极型缓蚀剂,它包括促进阳极钝化的氧化剂(铬酸盐、亚硝酸盐、铁离子等)或阳极成膜剂(碱、磷酸盐、硅酸盐、苯甲酸盐等),它们主要在阳极区域反应,促进阳极极化。一般阳极缓蚀剂会在阳极表面生成保护膜,这种情况下的缓蚀效果较好,但也存在一定风险,因为如果剂量不充足,会造成保护膜不完整,膜缺陷处暴露的裸金属面积小,阳极电流密度大,更容易发生穿孔。另一类缓蚀剂是在阴极反应,如钙离子、锌离子、镁离子、铜离子、锰离子等与阴极产生氢氧根离子,形成不溶性的氢氧化物,以厚膜形态覆盖在阴极表面,因而阻滞氧扩散到阴极,增大浓差极化。除此之外,也有同时阻滞阳极和阴极的混合型缓蚀剂,但加入量一般都需要先通过试验才可确定。 2有机缓蚀剂 有机缓蚀剂是吸附型的,吸附在金属表面,形成几个分子厚的不可视膜,可同时阻滞阳极和阴极反应,但对二者的影响力稍有不同。常用无机缓蚀剂有含氮、含硫、含氧及含磷的有机化合物,其吸附类型随有机物分子构型的不同可分为静电吸附、化学吸附及π键(不定位电子)吸附。有机缓蚀剂的发展很快,用途十分广泛,但是使用它同时也会产生一些缺点,如污染产品,特别是食品类,缓蚀剂可能对生产流程的这一部分有利,但进入另一部分则变为有害物质,也有可能会阻抑需要的反应,如酸洗时使去膜速度过缓,等。 3气相缓蚀剂 这类缓蚀剂是挥发性很高的物质,含有缓蚀基团,一般用来保护贮藏和运输中的金属零部件,以固体形态应用居多。它的蒸汽被大气中的水分解出有效的缓蚀基团,吸附在金属表面,达到减缓腐蚀的目的。另外,它也是一种吸附性缓蚀剂,被保护的金属表面不需要除锈处理。 化工设备的腐蚀与预防腐蚀措施示范文本 In The Actual Work Production Management, In Order To Ensure The Smooth Progress Of The Process, And Consider The Relationship Between Each Link, The Specific Requirements Of Each Link To Achieve Risk Control And Planning 某某管理中心 XX年XX月 化工设备的腐蚀与预防腐蚀措施示范文 本 使用指引:此解决方案资料应用在实际工作生产管理中为了保障过程顺利推进,同时考虑各个环节之间的关系,每个环节实现的具体要求而进行的风险控制与规划,并将危害降低到最小,文档经过下载可进行自定义修改,请根据实际需求进行调整与使用。 【摘要】随着经济的发展,对化工产品的需求不断增 加,越来越多生产设备的运行超出设计能力,因而目前对 化工企业而言,防止工艺设备因受到腐蚀发生故障而造成 损失已成为迫在眉睫的问题。许多专家认为,材料保护和 防腐措施是降低维护费用和使工厂安全稳定运行的重要保 证。 【关键词】化工设备;腐蚀;防腐蚀 随着经济的发展,对化工产品的需求不断增加,越来 越多生产设备的运行超出设计能力,因而目前对全球的化 工企业而言,防止工艺设备因受到腐蚀发生故障而造成损 失已成为迫在眉睫的问题。许多专家认为,材料保护和防 腐措施是降低维护费用和使工厂安全稳定运行的重要保证。 腐蚀破坏到处可见,腐蚀事故频频发生,这除了因腐蚀本身所具有的自发性质外,很大程度上是因为人们对腐蚀的危害性估计不足,对腐蚀防护的重要意义认识不深,对腐蚀与防护科学缺乏应有的知识,没有采取防腐蚀措施、或采取的防腐蚀措施不当所致。 1.1腐蚀的分类 腐蚀:材料与周围环境发生作用而被破坏的现象。 腐蚀按材料种类分为金属腐蚀和非金属腐蚀。 腐蚀按表面形貌分为全面腐蚀和局部腐蚀;局部腐蚀又有小孔腐蚀、应力腐蚀破裂、缝隙腐蚀、电偶腐蚀、磨损腐蚀等等; 金属腐蚀按机理可分为物理腐蚀、化学腐蚀、电化学腐蚀等。 金属防腐的影响因素 一般讲,金属的腐蚀是多种因素共同作用的结果,而其中某种因素在腐蚀过程中起着重要的作用。金属表面喷漆形成涂装保护层,其金属发生腐蚀的区域是在涂装漆膜与金属表面的界面区域,并不断向金属基体深处侵蚀扩张。 金属的防腐蚀过程目前分为三大类:金属的阳极保护;金属的阴极保护;以及金属表面的非金属涂装保护。金属的阳极保护是指在某种金属表面镀覆一种电极电位较低的金属材料,在腐蚀环境中电位较低的金属材料首先被腐蚀而起到一种保护作用(如:钢铁表面镀覆金属锌);金属的阴极保护是指在金属表面镀覆一种电位较高的耐腐蚀金属材料,在腐蚀环境中将低电位金属完全包覆,把低电位金属与腐蚀性物质隔绝开来(如:钢铁表面镀铜); 喷漆涂装金属腐蚀因素分析和预防的方法 1金属材质等因素的影响 喷漆涂装金属的腐蚀与金属材质本身耐蚀性有很大关系。用于以喷漆涂装的金属有钢铁材料,铝合金,铜合金或镁合金等,无疑金属材质的不同,金属喷漆涂装的抗蚀防腐性能也不尽相同。金属材料表面状态的差异,经喷漆涂装,其涂层的防腐抗蚀保护效果有明显的不同。比如将经喷砂净化处理的钢板材零件和自然锈蚀的同牌号钢板零件进行同类喷漆涂装保护,由于锈蚀的不利影响,天然锈蚀钢板零件较经喷砂的钢板零件其腐蚀速率高出数十倍,其抗蚀防护效果明显低于后者。金属表面所存在的缺陷如夹杂、微裂、应力等和大气中水分及活性离子(Cl-、Br-等)的吸附都会不同程度地影响甚至加速喷漆涂装金属的腐蚀。 金属表面喷漆涂装前的净化脱脂,活化除锈等前处理及表面处理工艺的应用都可以有效地改善喷漆涂装金属的防腐抗蚀性能。生产实践证明喷漆涂装金属防腐性的优劣与其涂装前基体前处理质量的好坏影响极大,金属(尤其是铸件)表面涂装前所进行的有效除油脱脂,除锈或采用喷砂喷丸等可以引起净化活化表面,保证涂装漆膜与基体金属良好的结合力,对提高喷漆涂装金属的耐腐蚀性能是十分有益的。 钢铁材料涂装前处理工序的磷化处理是广泛地做为喷漆涂装的底层,对提高涂装层附着力和提高涂装金属的防腐抗蚀性能是无可非议的。 铝合金的磷化、化学氧化、阳极氧化处理等都可做为喷漆涂装的底层,对改善和提高涂装金属耐蚀性能无疑是优良的。 总之,对金属基材良好的表面处理工艺是提高喷漆涂装金属耐腐蚀性的重要一环和可靠基础。 2金属喷漆涂装施工工艺及环境的影响 金属表面的清洁程度严重影响涂装喷漆层的结合力,制件表面残留或吸附的水、油污及其它异物等消除不净,往往会产生针孔、结瘤、起皮或结合不良等故障。 钢铁零件磷化处理后,铝合金零件化学氧化或阳极化处理后,镁合金零件化学氧化处理后等,均要在不超过24小时内及时进行喷漆涂装,钢铁零件经喷砂、喷丸处理也必须在六小时内进行喷漆涂装。这一工艺措施是实践证明的有助于提高涂装膜层与基体附着力,增强其抗蚀性能的好办法。 一、填空题 1.腐蚀的定义:物质(通常是金属)或其性能由于与环境发生反应所引起的变质。 2.金属腐蚀测试方法按测试方法的性质可分为物理的、化学的和电化学的的试验方法。 3.在重量法中清除腐蚀产物的方法有:机械法、化学清洗法、电解去膜法。 4.在确定采用何种腐蚀研究方法时应从腐蚀介质、金属材质、腐蚀类型等三方面综合考虑。 5.腐蚀试验结果的误差包括系统误差和偶然偏差。 6.参比电极必需具备的性能有1)参比电极应是可逆电极,它的电极电位时可逆电位,符 合能斯特电极电位公式、2)电极过程的交换电流密度高,不易极化、3)具有良好的电位稳定性和重现性、4)如果参比电极突然流过电流,断电后其电极电位应很快回复到原先的电位值、5)电极电位随温度的变化小、6)制备、使用、维护简单方便。 7.当两种不同金属在介质中相互接触,其中自腐蚀电位较负的金属在接触处的局部腐蚀速 度将加剧,而自腐蚀电位较正的金属在接触处的局部腐蚀速度将减慢。 二、不定项选择题 1.下列电极中,在任何温度时电极电位均为零的是:(C) A 饱和甘汞电极 B 银—氯化银电极 C 标准氢电极 D 铜—硫酸铜电极 2.下述方法中不属于电化学测试方法的有:(A、C) A 重量法 B 极化曲线法 C 电阻法 D电偶法 E 交流阻抗法 3.某金属工件由异种金属铆钉铆接而成,其工作时处于腐蚀介质中,从安全角度考虑,应 选用:(B) A 小阳极大阴极结构 B 大阳极小阴极结构 C A、B都可以 4.在经典电化学测试中,应通过盐桥与体系相连的是:(B) A 辅助电极 B 参比电极 C 工作电极 D全部需要 5.在测定金属M M与参比电极组成的电池的开路电压V且连接 电极M(A) 6.A、B (A) 7.金属腐蚀速率最常用的三种指标是:(A、B、C) A 重量指标 B 深度指标 C 电流指标 D机械强度指标 8.一个金属浸在被氢气饱和的溶液中,则金属的有效溶解速度可表示为:(B)金属腐蚀机理及分类
设备防腐蚀办法
化工设备的腐蚀与预防腐蚀措施示范文本
金属防腐的影响因素
腐蚀测试方法
