第十一章 分子结构

第十一章分子结构
1. 解释下列概念:
(1) σ键和π键
(2) 极性共价键和非极性共价键、极性分子和非极性分子
(3) 氢键和范德华力
(4) 等性杂化和不等性杂化
(5) 成键轨道和反键轨道
解: (1) σ键是s—s,s—p x,p x—p x原子轨道以头碰头方式重叠形成的共价键,成键电子云分布在两核之间,稳定性比较大。π键是由p y—p y,p z—p z以肩并肩方式重叠形成的,成键电子云分布在x轴所在平面的上下两侧,π键不能单独存在,只能存在于共价双键或共价叁键中,比σ键的稳定性小,容易发生反应。
(2) 同种元素原子间形成的共价键,正、负电荷重心重合,这样的共价键为非极性共价键;电负性不同的两元素原子间形成的共价键,正、负电荷重心不能完全重合,一端带部分正电荷,另一端带部分负电荷,这样的共价键为极性键。以共价键形成的分子,如果分子的正、负电荷重心重合,则为非极性分子;如果分子的正、负电荷重心不能重合,这样的分子就是极性分子,分子的偶极矩大于零。分子的极性和键的极性以及分子的空间构型有关。
(3) 氢原子与电负性很大(如N、O、F)半径很小的原子结合以后,几乎成为裸露的质子,正电荷密度很大,可以与另一个电负性很大半径很小的原子产生强烈的相互吸引作用,这种作用力就叫做氢键。氢键有方向性和饱和性。分子间存在一种只有化学键键能的1/10—1/100的弱的作用力,最早由荷兰物理学家van der Waals提出,故称作范德华力。包括取向力、诱导力、色散力三种。
(4) 原子轨道杂化后所形成的杂化轨道的成分和能量完全等同,这样的杂化就叫做等性杂化。如果原子轨道杂化以后所形成的杂化轨道的能量和成分不完全相同,这样的杂化叫做不等性杂化。如水分子、氨分子在形成时中心原子采用的就是不等性sp3杂化。
(5) 原子轨道线性组合形成分子轨道时,在形成的分子轨道中一半的分子轨道能量降低,叫做成键轨道。另一半的分子轨道能量升高叫做反键轨道。参加线性组合的原子轨道数和形成的分子轨道数相等。
2. 结合Cl2分子的形成,说明共价键形成的条件并解释为什么共价键具有方向性和饱和性。
解:Cl的价电子组态为3s23p5,有一个未成对电子,若该电子处于3p x轨道,在形成氯分子时,两个氯原子的3p x单电子轨道相互重叠,形成一个σ键。当这两个原子轨道相互重叠时,必须按一定的空间取向,沿x轴的方向才能实现最大重叠成键,在其它方向上不能有效重叠成键,所以说共价键有方向性。形成一个共价键后,电子全部配对,没有了单电子,就不能再形成其它的共价键,这就是共价键的饱和性。
3. 指出下列分子中哪些是极性分子?哪些是非极性分子?
HBr,CS2,CHCl3,PCl3,H2S,CCl4
解:HBr为双原子分子,极性共价键,是极性分子;
CS2的空间构型为直线形,结构对称,为非极性分子;
CHCl 3 的空间构型为四面体,结构不对称,为极性分子;
PCl 3的空间构型为三角锥形,结构不对称,为极性分子;
H 2S 的空间构型为V 形,结构不对称,为极性分子。
CCl 4的空间构型为正四面体,结构对称,为非极性分子。
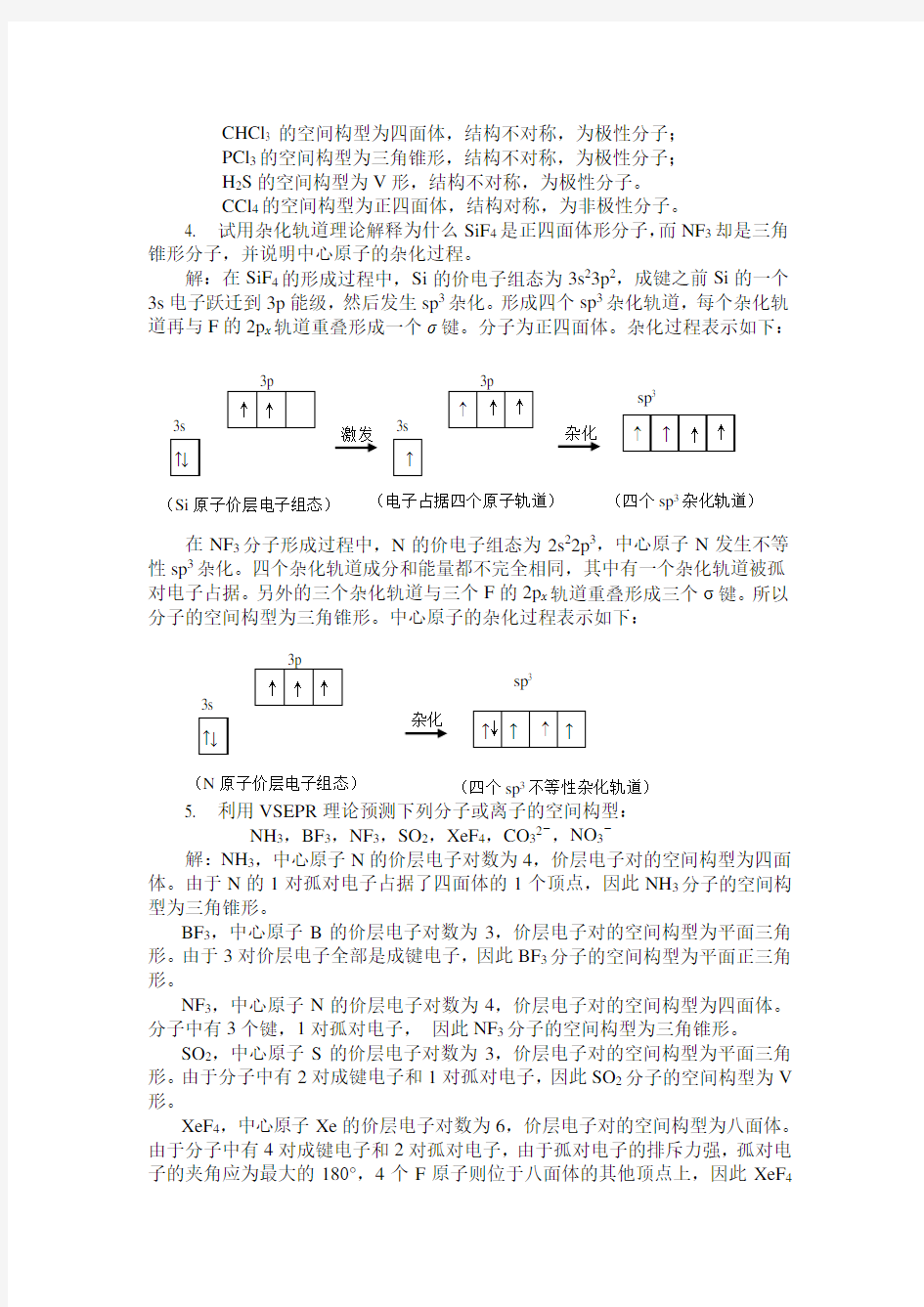
4. 试用杂化轨道理论解释为什么SiF 4是正四面体形分子,而NF 3却是三角锥形分子,并说明中心原子的杂化过程。
解:在SiF 4的形成过程中,Si 的价电子组态为3s 23p 2,成键之前Si 的一个3s 电子跃迁到3p 能级,然后发生sp 3杂化。形成四个sp 3杂化轨道,每个杂化轨道再与F 的2p x 轨道重叠形成一个σ键。分子为正四面体。杂化过程表示如下:
在NF 3分子形成过程中,N 的价电子组态为2s 22p 3,中心原子N 发生不等性sp 3杂化。四个杂化轨道成分和能量都不完全相同,其中有一个杂化轨道被孤对电子占据。另外的三个杂化轨道与三个F 的2p x 轨道重叠形成三个σ键。所以分子的空间构型为三角锥形。中心原子的杂化过程表示如下:
5. 利用VSEPR 理论预测下列分子或离子的空间构型:
NH 3,BF 3,NF 3,SO 2,XeF 4,CO 32-,NO 3-
解:NH 3,中心原子N 的价层电子对数为4,价层电子对的空间构型为四面体。由于N 的1对孤对电子占据了四面体的1个顶点,因此NH 3分子的空间构型为三角锥形。
BF 3,中心原子B 的价层电子对数为3,价层电子对的空间构型为平面三角形。由于3对价层电子全部是成键电子,因此BF 3分子的空间构型为平面正三角形。
NF 3,中心原子N 的价层电子对数为4,价层电子对的空间构型为四面体。分子中有3个键,1对孤对电子, 因此NF 3分子的空间构型为三角锥形。
SO 2,中心原子S 的价层电子对数为3,价层电子对的空间构型为平面三角形。由于分子中有2对成键电子和1对孤对电子,因此SO 2分子的空间构型为V 形。
XeF 4,中心原子Xe 的价层电子对数为6,价层电子对的空间构型为八面体。由于分子中有4对成键电子和2对孤对电子,由于孤对电子的排斥力强,孤对电子的夹角应为最大的180°,4个F 原子则位于八面体的其他顶点上,因此XeF 4
(Si 原子价层电子组态) ↑ 3s 3p ↑ ↑ 激发 ↑ 3s 3p ↑ (电子占据四个原子轨道) ↑ ↑ (四个sp 3杂化轨道) 杂化 sp 3 ↑ ↑ ↑ ↑ ↓ (N 原子价层电子组态) ↑ 3s 3p ↑ ↑ ↑ (四个sp 3不等性杂化轨道)
杂化 sp 3
↑ ↑ ↓ ↓ ↑ ↑
分子的空间构型为平面四方形。
CO32-,中心原子C的价层电子对数为3,价层电子对的空间构型为平面三角形。由于3对电子均为成键电子,因此CO32-的空间构型为平面正三角形。
NO3-,中心原子N的价层电子对数为3,价层电子对的空间构型为平面三角形。由于分子中含1个单键和2个双键,且有共振结构,无孤对电子,因此NO3-的空间构型为平面正三角形。
6. 指出下列化合物中成键原子可能采取的杂化类型。
(1) CS2;(2) BI3;(3) SbI3;(4) CCl4
解: (1) CS2分子的空间构型是直线,C原子采取sp杂化。
(2) BI3分子的空间构型是平面正三角型,B原子采取sp2杂化。
(3) SbI3 分子的空间构型为三角锥形,Sb原子采取不等性sp3杂化。
(4) CCl4分子的空间构型为正四面体,C原子原子采取sp3杂化。
7. H3O+离子的中心原子O采取何种杂化类型,中心原子的价层电子对构型和离子的构型怎样?
解:H3O+离子的中心原子O采取sp3不等性杂化,离子中存在2个σ键,1个配位键。价层电子对构型为四面体形,离子的构型为三角锥形。
8. 试用分子轨道理论说明为什么Be2不能稳定存在,而B2却为顺磁性分子?
解:基态Be原子的电子构型为1s21s2,基态B原子的电子构型为1s22s22p1。按分子轨道理论,Be2 的分子轨道表示式为( σ1s )2 ( σ1s* )2 ( σ2s )2 ( σ2s* )2,键级为0,两个Be原子不能形成共价键,因此Be 2不能稳定存在。
B2 的分子轨道表示式为( σ1s )2 ( σ1s* )2 ( σ2s )2 ( σ2s* )2(π2py)1(π2pz)1,分子中有2个单电子,因此B2为顺磁性分子。键级为1,说明在两个B原子间形成共价键,且只存在的是π键。
9. 写出HF分子的分子轨道式,画出分子轨道图,并以此为例说明非键分子轨道概念,指出图中的非键轨道是在什么条件下形成的。
解:HF分子为异核双原子分子,H原子的1s能量和F原子最外层的2p能量接近。根据对称性匹配和能量近似原则,H的1s只能和F的2p轨道组合成σ分子轨道,而F原子的其他轨道对形成HF分子没有贡献,不经过组合且保留它们原来的能量状态而直接形成分子轨道——非键分子轨道(用#标注)。因为组合成分子轨道的原子轨道的量子数不同,所以HF分子的分子轨道式写为HF[( 1σ# )2 (2σ#)2 ( 3σ)2 ((1π#)4]。
4σ#
1s ↑
1π↑↓↑↓↑↓↑↓↓2p
3σ↑↓
2σ# ↑↓↑↓2s
1σ#↑↓↑↓1s
10. 为什么水的沸点比氧的同族元素(S、Se等)氢化物的沸点高得多?
解:H2O分子间除了存在分子间力以外还存在分子间氢键。而H2S、H2Se 中不存在分子间氢键,所以水的沸点高得多。
11. 下列分子结构有无产生氢键的可能?是分子内氢键还是分子间氢键?
(1) NH 3 (2) C 6H 6 (3) (4)
解:(1) NH 3中可以形成分子间氢键。(2) C 6H 6不能产生氢键。
(3) 可以产生分子间氢键。(4) 可以产生分子内氢键。 12. 今有下列双原子分子或离子:Li 2,Ne 2,CO +,O 2-,O 2
(1) 写出它们的分子轨道式。
(2) 计算它们的键级,判断其中哪个最稳定?哪个最不稳定?
(3) 判断哪些分子或离子是顺磁性的?哪些是反磁性的?
解: Li 2 [KK(σ2S )2 ] 键级=1,分子中没有单电子,是反磁性。
Ne 2 [ KK(σ2S )2(σ*2S )2 (σ2px )2(π2py )2(π2pz )2(π*2py )2(π*2pz )2 (σ*2px )2] 键级=0,分子不存在。
CO + [KK(σ2S )2(σ*2S )2(π2py )2(π2pz )2(σ2px )1 ] 键级=2.5,有1个单电子,顺磁性。
O 2- [KK(σ2s )2(σ*2s )2(σ2px )2(π2py )2(π2pz )2(π*2py )2(π*2pz )1 ] 键级=1.5,1个单电子,顺磁性。
O 2 [KK(σ2s )2(σ*2s )2(σ2px )2(π2py )2(π2pz )2(π*2py )1(π*2pz )1 ] 键级=2,有2个单电子,顺磁性。
最稳定的是CO +,最不稳定的是Be 2 。
13. 预测下列分子的空间构型,指出电偶极矩是否为零并判断分子的极性。
SiF 4、NF 3、BCl 3、H 2S 、CHCl 3
解: SiF 4为正四面体,电偶极矩为零,非极性分子。
NF 3为三角锥,电偶极矩大于零,极性分子。
BCl 3为平面正三角形,电偶极矩为零,非极性分子。
H 2S 为V 字型,电偶极矩大于零,极性分子。
CHCl 3为四面体,电偶极矩大于零,极性分子。
14. 解释下列稀有气体的沸点数据的规律:
物质各称:He Ne Ar Kr Xe
沸点(K):4.26 27.26 87.46 120.26 166.06
解: He Ne Ar Kr Xe 是在同一个族中,在同一主族中,元素原子半径增大是矛盾的主要方面,起主导作用,有效核电荷的增加,相对影响弱。所以,随着元素原子序数的增加,原子半径增大,色散力逐渐增大,导致了随元素原子序数增加沸点升高。
15. 常温下F 2和Cl 2为气体,Br 2为液体,I 2为固体,原因是什么?
解:F 2、Cl 2、Br 2、I 2为卤素单质,都是非极性分子,分子间只存在色散力,它们都是主族元素,在同一主族中,随元素原子序数的增加,原子半径逐渐增大,分子的体积越来越大,色散力同样逐渐增大,这样就使得这些单质双原子分子的分子间的色散力逐渐增大,熔、沸点升高。所以,常温下F 2和Cl 2为气体,Br 2为液体,I 2为固体。
16. 判断下列各组分子之间存在什么形式的作用力。
CHO OH OH CHO
CHO OH OH CHO
(1) C6 H6和CCl4(2) He和H2O (3) CO2气体
(4) HBr气体(5) CH3OH和H2 O
解:(1) C6H6和CCl4均为非极性分子,C6H6分子与CCl4分子之间只存在色散力。
(2) He为非极性分子,而H2O为极性分子,He分子与H2O分子之间存在诱导力和色散力。
(3) CO2为非极性分子,CO2分子之间只存在色散力。
(4) HBr分子为极性分子,HBr分子之间存在取向力、诱导力和色散力。
(5) CH3CH2OH和H2O均为极性分子,CH3CH2OH分子与H2O分子之间存在取向力、诱导力和色散力;此外,在CH3CH2OH分子与H2O分子之间还存在分子间氢键.
17. 请解释为什么冰越冻越结实,而常温下很柔软的塑料则在液氮的低温下一敲就碎?
解:冰中作用力有氢键,温度越低,分子的热运动越少,氢键稳定性越高,因此温度越低冰越结实;塑料分子间作用力是范德华力,以色散力为主,温度越低,分子间作用力越小,在液氮的低温环境下,分子间作用力变得很小,所以变得易碎。
大学无机化学第六章试题及答案
第六章化学键理论 本章总目标: 1:掌握离子键、共价键和金属键的基本特征以及它们的区别; 2:了解物质的性质与分子结构和键参数的关系; 3:重点掌握路易斯理论、价电子对互斥理论、杂化轨道理论以及分子轨道理论。 4:熟悉几种分子间作用力。 各小节目标: 第一节:离子键理论 1:掌握离子键的形成、性质和强度,学会从离子的电荷、电子构型和半径三个方面案例讨论离子的特征。 2:了解离子晶体的特征及几种简单离子晶体的晶体结构,初步学习从离子的电荷、电子构象和半径三个方面来分析离子晶体的空间构型。 第二节:共价键理论 1;掌握路易斯理论。 2:理解共价键的形成和本质。掌握价键理论的三个基本要点和共价键的类型。3:理解并掌握价层电子对互斥理论要点并学会用此理论来判断共价分子的结构,并会用杂化轨道理论和分子轨道理论来解释分子的构型。 第三节:金属键理论 了解金属键的能带理论和三种常见的金属晶格。 第四节:分子间作用力 1:了解分子极性的判断和分子间作用力(范德华力)以及氢键这种次级键的形成原因。 2;初步掌握离子极化作用及其强度影响因素以及此作用对化合物结构及性质的影响。 习题 一选择题
1.下列化合物含有极性共价键的是()(《无机化学例题与习题》吉大版) 2 C. Na 2 O 2.下列分子或离子中键能最大的是() A. O 2 C. O 2 2+ D. O 2 2- 3. 下列化合物共价性最强的是()(《无机化学例题与习题》吉大版) C. BeI 2 4.极化能力最强的离子应具有的特性是() A.离子电荷高,离子半径大 B.离子电荷高,离子半径小 C.离子电荷低,离子半径小 D.离子电荷低,离子半径大 5. 下列化合物中,键的极性最弱的是()(《无机化学例题与习题》吉大版) 3 C. SiCl 4 6.对下列各组稳定性大小判断正确的是() +>O 22- B. O 2 ->O 2 C. NO+>NO D. OF->OF 7. 下列化合物中,含有非极性共价键的离子化合物是()(《无机化学例题与习题》吉大版) 3 C. Na 2 O 2 8.下列各对物质中,是等电子体的为() 和O 3 B. C和B+ C. He和Li D. N 2 和CO 9. 中心原子采取sp2杂化的分子是()(《无机化学例题与习题》吉大版) 3 C. PCl 3 10.下列分子中含有两个不同键长的是()
(完整版)结构化学课后答案第二章
02 原子的结构和性质 【2.1】氢原子光谱可见波段相邻4条谱线的波长分别为656.47、486.27、434.17和410.29nm ,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R 及整数n 1、n 2的数值。 2212 11 ( )R n n ν=-% 解:将各波长换算成波数: 1656.47nm λ= 1115233v cm - -= 2486.27nm λ= 1220565v cm - -= 3434.17nm λ= 1323032v cm - -= 4410.29nm λ= 1424373v cm - -= 由于这些谱线相邻,可令1n m =,21,2,n m m =++……。列出下列4式: ()2 2152331R R m m = - + ()22205652R R m m =- + ()2 2230323R R m m = - + ()2 2243734R R m m =- + (1)÷(2)得: ()()()2 3212152330.7407252056541m m m ++==+ 用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得: 1109678R cm -= 因而,氢原子可见光谱(Balmer 线系)各谱线的波数可归纳为下式: 221211v R n n - ??=- ? ?? 式中, 1 12109678,2,3,4,5,6R cm n n -===。 【2.2】按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。 解:根据Bohr 提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即:
第二章 分子结构-答案
第二章 化学键和分子结构 一.选择题 1. 下列分子或离子中,键角最小的是( ) A. HgCl 2 B. H 2O C. NH 3 D. PH 3 2. 关于原子轨道的说法正确的是( ) A.凡中心原子采取sp 3杂化轨道成键的分子其几何构型都是正四面体; B. CH 4分子中的sp 3杂化轨道是由4个H 原子的1s 轨道和C 原子的2p 轨道混 合起来而形成的 ; C. sp 3 杂化轨道是由同一原子中能量相近的s 轨道和p 轨道混合起来形成的一 组能量相等的新轨道; D. 凡AB 3型的共价化合物,其中心原子A 均采用sp 3杂化轨道成键。 3. 下列化合物中氢键最强的是( ) A. CH 3OH B. HF C. H 2O D. NH 3 4. 对羟基苯甲醛比邻羟基苯甲醛的熔沸点高的原因是( ) A. 前者不能形成氢键,后者可以; B. 前者能形成氢键,后者不能; C. 前者形成分子间氢键,后者形成分子内氢键; D. 前者形成分子内氢键,后者形成分子间氢键。 5. 下列各组物质沸点高低顺序中正确的是( ) A. HI>HBr>HCl>HF B. H 2Te>H 2Se>H 2S>H 2O C. NH 3>AsH 3>PH 3 D. CH 4>GeH 4>SiH 4 6. I 2的CCl 4溶液中分子间主要存在的作用力是( ) A. 色散力 B. 取向力 C. 取向力、诱导力、色散力 D. 氢键、诱导力、色散力 7. 下列分子中偶极矩为零的是( ) A. NF 3 B. NO 2 C. PCl 3 D. BCl 3 8. 下列分子是极性分子的是( ) A. BCl 3 B. SiCl 4 C. CHCl 3 D.. BeCl 2 9. 下列离子或分子有顺磁性的是( ) A. O 2 B. O 22- C. N 2 D. CO 10. 下列分子中心原子是sp 2杂化的是( ) A. PBr 3 B. CH 4 C. BF 3 D. H 2O 11. SO 42-离子的空间构型是( ) A. 平面正方形 B. 三角锥形 C. 四面体 D. 八面体 12. 下列各物质分子其中心原子以sp 2杂化的是( )
第二章 分子结构-答案
第二章化学键和分子结构 一.选择题 1.下列分子或离子中,键角最小的是( ) A. HgCl2 B. H2O C. NH3 D. PH3 2.关于原子轨道的说法正确的是( ) A.凡中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体; B. CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混 合起来而形成的; C. sp3杂化轨道是由同一原子中能量相近的s轨道和p轨道混合起来形成的一 组能量相等的新轨道; D. 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键。 3.下列化合物中氢键最强的是( ) A. CH3OH B. HF C. H2O D. NH3 4.对羟基苯甲醛比邻羟基苯甲醛的熔沸点高的原因是( ) A. 前者不能形成氢键,后者可以; B. 前者能形成氢键,后者不能; C. 前者形成分子间氢键,后者形成分子内氢键; D. 前者形成分子内氢键,后者形成分子间氢键。 5.下列各组物质沸点高低顺序中正确的是( ) A. HI>HBr>HCl>HF B. H2Te>H2Se>H2S>H2O C. NH3>AsH3>PH3 D. CH4>GeH4>SiH4 6.I2的CCl4溶液中分子间主要存在的作用力是( ) A. 色散力 B. 取向力 C. 取向力、诱导力、色散力 D. 氢键、诱导力、色散力 7.下列分子中偶极矩为零的是( ) A. NF3 B. NO2 C. PCl3 D. BCl3 8.下列分子是极性分子的是( ) A. BCl3 B. SiCl4 C. CHCl3 D.. BeCl2 9.下列离子或分子有顺磁性的是( ) A. O2 B. O22- C. N2 D. CO 10.下列分子中心原子是sp2杂化的是( ) A. PBr3 B. CH4 C. BF3 D. H2O 11.SO42-离子的空间构型是( ) A. 平面正方形 B. 三角锥形 C. 四面体 D. 八面体 12.下列各物质分子其中心原子以sp2杂化的是( ) A. H2O B. NO2 C. SCl2 D. CS2
人教版-选修3-第二章分子结构与性质全章教案
人教版-选修3-第二章分子结构与性质全章教案 第二章分子结构与性质 教材分析 本章比较系统的介绍了分子的结构和性质,内容比较丰富。首先,在第一章有关电子云和原子轨道的基础上,介绍了共价键的主要类型σ键和π键,以及键参数——键能、键长、键角;接着,在共价键概念的基础上,介绍了分子的立体结构,并根据价层电子对互斥模型 和杂化轨道理论对简单共价分子结构的多样性和复杂性进行了解释。最后介绍了极性分子和 非极性分子、分子间作用力、氢键等概念,以及它们对物质性质的影响,并从分子结构的角 度说明了“相似相溶”规则、无机含氧酸分子的酸性等。 化学2已介绍了共价键的概念,并用电子式的方式描述了原子间形成共价键的过程。本章第一节“共价键”是在化学2已有知识的基础上,运用的第一章学过的电子云和原子轨道的概 念进一步认识和理解共价键,通过电子云图象的方式很形象、生动的引出了共价键的主要类 型σ键和π键,以及它们的差别,并用一个“科学探究”让学生自主的进一步认识σ键和π键。 在第二节“分子的立体结构”中,首先按分子中所含的原子数直间给出了三原子、四原子和五原子分子的立体结构,并配有立体结构模型图。为什么这些分子具有如此的立体结构呢? 教科书在本节安排了“价层电子对互斥模型”和“杂化轨道理论”来判断简单分子和离子的 立体结构。在介绍这两个理论时要求比较低,文字叙述比较简洁并配有图示。还设计了“思考与交流”、“科学探究”等内容让学生自主去理解和运用这两个理论。 在第三节分子的性质中,介绍了六个问题,即分子的极性、分子间作用力及其对物质性质的 影响、氢键及其对物质性质的影响、溶解性、手性和无机含氧酸分子的酸性。除分子的手性 外,对其它五个问题进行的阐述都运用了前面的已有知识,如根据共价键的概念介绍了键的 极性和分子的极性;根据化学键、分子的极性等概念介绍了范德华力的特点及其对物质性质 的影响;根据电负性的概念介绍了氢键的特点及其对物质性质的影响;根据极性分子与非非 极性分子的概念介绍了“相似相溶”规则;根据分子中电子的偏移解释了无机含氧酸分子的 酸性强弱等;对于手性教科书通过图示简单介绍了手性分子的概念以及手性分子在生命科学 和生产手性药物方面的应用 第二章分子结构与性质 第一节共价键 第一课时
第二章 分子结构
1. S F4分子具有( )[ID: 881] A B C D 2. 下列哪种分子的偶极矩不等于零?( )[ID: 909] A B C D 3. 下列化合物中哪种分子偶极矩为零?( )[ID: 910] A B C D 4. 下列哪一种分子或原子在固态时是范德华力所维持的?( )[ID: 911] A
B C D 5. 下列化合物中哪个不具有孤对电子?( )[ID: 912] A B C D 6. O F2分子的电子结构是哪种杂化?( )[ID: 913] A B C D 7. 下列化合物中哪一个氢键表现最强?( )[ID: 914] A B C D 8. 用价电子对互斥理论推测下列分子构型:PCl5、HOCl 、XeF2、ICl4-、IF5分别属于( )[ID: 915]
A B C D 9. 指出下列化合物中,哪一个化合物的化学键极性最小?( )[ID: 916] A B C D 10. 要组成有效分子轨道需满足成键哪三原则?( )[ID: 917] A B C D 11. 由分子轨道理论可知( )[ID: 918] A B C D
12. 指出下列化合物中,哪个化合物的化学键极性最大?( )[ID: 919] A B C D 13. 下列分子中,两个相邻共价键间夹角最小的是( )[ID: 920] A B C D 14. 下列说法中正确的是( )[ID: 921] A B C D 15. 下列化学键中,极性最弱的是( )[ID: 922] A B C
D 16. 下列说法中不正确的是 ( )[ID: 923] A B C D 17. 下列原子轨道中各有一个自旋方向相反的不成对电子,则沿x 轴方向可形成 σ键的是 ( )[ID: 924] A B C D 18. 下列分子或离子中,键角最大的是 ( )[ID: 925] A B C D 19. 下列说法中,正确的是 ( )[ID: 926] A
第九章 分子结构
第九章分子结构 (9-2) (1)如果分子构型为直线形,其中心原子有可能为sp杂化,也有可能为sp3d 杂化(中心原子共有五对价电子),因此HgCl2中Hg以sp杂化轨道与配位原子Cl成键。 (2)正四面体构型的分子或离子,其中心原子只可能为sp3杂化。SiF4中Si 以SP3杂化成键。 (3)平面三角形构型的分子或离子,中心原子为sp2杂化。BCl3中B以sp2杂化轨道成键。 (4)三角锥形的分子或离子,其中心原子以sp3不等性杂化轨道成键,并具有一对孤对电子,NF3正是这种情形。 (5)V形分子或离子的中心原子有可能是sp2杂化(只有一对孤对电子)或sp3杂化(有2对孤对电子)。画出N02-的点式结构,N上只有一对孤对电子,所以NO2-中N为sp2杂化轨道成键。 *解答本题时,只是从中心原子的杂化轨道类型、孤对电子数与分子(或离子)空间构型的关系入手,并没有直接运用价层电子对互斥理论;也可以从分子构型和中心原子的成键特征来确定中心原子的杂化轨道。例如,配位数为2的汞化合物,Hg以sp杂化;BX3型的B为sp2杂化,SiX4型的Si为sp3杂化,NH3型的N为sp3不等性杂化,NH4+为sp3等性杂化,N03-和NO2-均为sp2杂化...... (9-3) 用VSEPR理论推断分子空间构型的思路是:先计算中心原子的价层电子对数,确定电子对的空间排布,再根据是否有孤对电子推测分子的空间构型(孤对电子数等于中心原子的价层电子对数减去配位原子数)。如果孤对电子数为零,则分子的空间构型与电子对的空间排布什一致的;有孤对电子存在时,两者不一致。中心原子的杂化轨道类型取决于中心原子的电子构型和其价层电子对数;中心原子的价层子对数等于其参与杂化的原子轨道数。 本题中6种分子的空间构型推测及其结果如下:
第二章 分子结构 (1)
一、选择题 1、CO分子中存在的化学键是(C ) A、Π键、?键 B、Π键、配位健 C、?键、Π键、配位健 D、?键、配位健 2、N 2 分子中存在的化学键是( D) A、一个Π键、一个?键 B、一个?键 C、一个Π键、两个?键 D、两个Π键、一个?键 3、下列分子中,两个相邻共价键的夹角最小的是 ( D ) A、BF 3 B、H 2 S C、NH 3 D、H 2 O 4、BF 3 分子的空间构型为(B ) A、直线型 B、平面正三角形 C、三角锥型 D、正四面体型 5、下列分子和离子中,中心原子成键轨道不是sp2杂化的是( D ) A、NO 3-B、HCHO C、BF 3 D、NH 3 6、NCl 3 分子中,N原子与三个氯原子成键所采用的轨道是( B ) A、两个sp轨道,一个p轨道成键 B、三个sp3轨道成键 C、P X、P y 、P z 轨道成键 D、三个sp2轨道成键 7、下列化合物中,极性最大的是( B ) A、CS 2 B、H 2 S C、SO 3 D、SnCl 4 8、下列分子中,偶极矩不等于零的是( C ) A、BeCl 2 B、BF 3 C、NF 3 D、CO 2 9、下列分子为极性分子的是(A ) A、H 2O B、CH 4 C、CO 2 D、BF 3 10、下列液态物质中只需克服色散力就能使之沸腾的是( D ) A、H 2 O B、CO C、HF D、Xe 11、极化能力最强的离子应具有的特性是(B ) A、离子电荷高、离子半径大 B、离子电荷高、离子半径小 C、离子电荷低、离子半径小 D、离子电荷低、离子半径大 12、下列各组离子中,离子的极化力最强的是( C ) A、K+、Li+ B、Ca2+、Mg2+ C、Fe3+、Ti4+ D、Sc3+、Y3+
第六章 分子结构及性质
第六章分子结构及性质 思考题解析 1.根据元素在周期表中的位置,试推测哪些元素原子之间易形成离子键。哪些元素原子之间易形成共价键? 解:周期表中的ⅠA、ⅡA族与ⅥA、ⅦA族元素原子之间由于电负性相差巨大,易形成离子键,而处于周期表中间的主族元素原子之间由于电负性相差不大,易形成共价键。 2.下列说法中哪些是不正确的,并说明理由。 (1)键能越大,键越牢固,分子也越稳定。 (2)共价键的键长等于成键原子共价半径之和。 (3)sp2杂化轨道是有某个原子的1s轨道和2p轨道混合形成的。 (4)中心原子中的几个原子轨道杂化时,必形成数目相同的杂化轨道。 (5)在CCl4、CHCl3和CH2Cl2分子中,碳原子都采用sp3杂化,因此这些分子都是正四面体形。 (6)原子在基态时没有未成对电子,就一定不能形成共价键。 (7)杂化轨道的几何构型决定了分子的几何构型。 解:(1)不正确。这只能对双原子分子而言。 (2)不正确。这只能对双原子分子而言。 (3)错。sp2杂化轨道是由某个原子的n s轨道和两个n p轨道混合形成的。 (4)正确。 (5)错。CCl4分子呈正四面体,而CHCl3和CH2Cl2分子呈变形四面体。 (6)错。原子在基态时的成对电子,受激发后有可能拆开参与形成共价键。 (7)错。如某些分子在成键时发生不等性杂化,则杂化轨道的几何构型与分子的几何构型就不一致。 3.试指出下列分子中哪些含有极性键? Br2CO2H2O H2S CH4 解:CO2、H2O、H2S、CH4分子中含有极性键。 4.BF3分子具有平面三角形构型,而NF3分子却是三角锥构型,试用杂化轨道理论进行解释。 解:BF3分子在成键时发生sp2等性杂化,所以呈平面三角形,而NF3分子在成键时发生sp3不等性杂化,所以呈三角锥形。 5.CH4、H2O、NH3分子中键角最大的是哪个分子?键角最小的是哪个分子?为什么?
【人教版】高中化学选修3知识点总结:第二章分子结构与性质
第二章分子结构与性质 课标要求 1.了解共价键的主要类型σ键和π键,能用键长、键能和键角等说明简单分子的某些性质 2.了解杂化轨道理论及常见的杂化轨道类型(sp、sp2、sp3),能用价层电子对互斥理论或者杂化轨道理论推测常见的简单分子或离子的空间结构。 3.了解简单配合物的成键情况。 4.了解化学键合分子间作用力的区别。 5.了解氢键的存在对物质性质的影响,能列举含氢键的物质。 要点精讲 一.共价键 1.共价键的本质及特征 共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。 2.共价键的类型 ①按成键原子间共用电子对的数目分为单键、双键、三键。 ②按共用电子对是否偏移分为极性键、非极性键。 ③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。 3.键参数 ①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。 ②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。 ③键角:在原子数超过2的分子中,两个共价键之间的夹角。 ④键参数对分子性质的影响 键长越短,键能越大,分子越稳定. 4.等电子原理[来源:学§科§网]
原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。 二.分子的立体构型 1.分子构型与杂化轨道理论 杂化轨道的要点 当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。 2分子构型与价层电子对互斥模型 价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。 (1)当中心原子无孤对电子时,两者的构型一致; (2)当中心原子有孤对电子时,两者的构型不一致。 3.配位化合物 (1)配位键与极性键、非极性键的比较
第八章分子
第八章构象分析 8.1 引言 理论分析:Barton 1950非化环已烷反应性 1. 构象分析发展归因于的研究。 实验技术:IR、NMR、X-ray的引入。 (1)Barton,1950在取代环已烷反应性的研究中,指出反应性受取代分子的赤道或轴向的性质所影响,即受取代环已烷构象所影响。 (2)实验技术的引入对分子结构的测定变得可能,并且随着能力的提高,测定分子的范围、精度越来越宽,越来越精确,即使这样,目前还是不能解决所有的分子结构测定。 譬如Protein分子晶体结构数据库,还是有限,原因晶体培养不出;NMR的溶液构象虽可测定,但分子太大也受限制。 因此在这种情况下利用理论分析方法是一种很好的补充。同时,理论方法进行构象分析的结果与实验测定的结果很接近。 ex1. 早期实验测得C-C键长为0.152nm;理计0.1530 - 0.1534 nm,后来更精确的实验测定为0.1528nm。 ex2. 1960年Hendricleson用理论方法计算了扭船式与椅式构象转化过程的能量为6.7KJ.mol-1,表明扭船式是可以存在的。 直到1975年科学家才在实验中证实了环已烷扭船式的存在,这就证明以上两者都是推动构象分析发展的基础。两者是相互相成的。 构象搜索 2. 构象分析的内容 构象与性能的关系研究 (1)构象搜素的目的是为了确定分子的优势构象,即寻找势能面上所有极小,因此能量极小化,在构象分析中起了极重要的作用。而执行能量优化的一个特征是,它们移动到最接近初始结构的极小点。因此,寻找一个产生初始结构为其后优化的各种算法是非常必要的。 什么是构象搜索?所谓构象搜索,在构象空间中寻找所有可能出现的比较稳定构象。即分子的势能面上寻找所有的极小值。 (2)构象与性能的关系研究 一个分子的物理、化学和生物性质关键是依赖于三维的结构即构象。特别是在生物体系中,生物大分子的功能更是依赖于构象(也称活性构象)。因此,构象分析在分子模拟中是一个十分重要的过程,而构象的搜索即寻找搜索的方法也是本章的重点。
第七章习题分子结构
第七章习题 1. 指出下列离子分边属于何种电子构型: Ti4+, Be2+, Cr3+, Fe2+, Ag+, Cu2+, Zn2+, Sn4+, Pb2+, Tl+, S2-, Br- 2. 已知KI的晶格能(U)为-631.9 kJ·mol-1,钾的升华热[S(K)]为90.0 kJ·mol-1,钾的电离能(I)为418.9 kJ·mol-1,碘的升华热[S(I)]为62.4kJ·mol-1,碘的解离能(D)为151 kJ·mol-1,碘的电子亲核能(E)为-310.5 kJ·mol-1,求碘化钾的生成热(△f H) 3. 根据价键理论画出下列分子的电子结构式(可用一根短线表示一对公用电子) BCl3, PH3, CS2, HCN, OF2, H2O2, N2H4, AsCl3, SeF6 4. 试用杂化轨道理论说明BF3是平面三角形,而NF3是三角锥形。 5. 指出下列化合物的中心原子可能采取的杂化类型,并预测其分子的几何构型。 BBr3, SiH4, PH3, SeF6 6. 将下列分子按照键角从大到小排列: BF3, BeCl2, SiH4, H2S, PH3, SF6 7. 用价层电子对互斥理论预言下列分子和离子的几何构型. CS2, NO2-, ClO2-, I3-, NO3-, BrF3, PCl4+, BrF-, PF5, BrF5, [AlF6]3- 8. 根据分子轨道理论比较N2和N2+键能的大小。 9. 根据分子轨道理论判断O2+, O2, O2-, O22-的键级和单电子数。 10. 用分子轨道理论解释: (1)氢分子离子H2+可以存在。 (2)Be2为顺磁性物质。 (3)N2分子不存在。 11. 试问下列分子中哪些是极性的?那些是非极性的?为什么? CH4, CHCl3, BCl3, NCl3, H2S, CS2 12. 试比较下列各对分子偶极矩的大小: (1) CO2和CS2(2) CCl4和CH4(3)PH3和NH3 (4)BF3和NF3(5)H2O和H2S 13. 将下列化合物按熔点从高到低的顺序排列: NaF,NaCl,NaBr,NaI,SiF4,SiCl4,SiBr4,SiI4 14. 试用离子极化观点解释: (1)KCl熔点高于GeCl4 (2)ZnCl2熔点低于CaCl2 (3)FeCl3熔点低于FeCl2 15. 下列说法是否正确?为什么? (1)分子中的化学键为极性键,则分子也为极性分子。 (2)Mn2O7中Mn(Ⅶ)正电荷高,半径小,所以该化合物的熔点比MnO高。 (3)色散力仅存在与非极性分子间。 (4)3电子π键比2电子π键的键能大。 16. 指出下列各对分子间存在的分子间作用力的类型(取向力、诱导力、色散力和氢键):(1)苯和CCl4(2)甲醇和H2O (3)CO2和H2O 4)HBr和HI 17. 下列化合物中哪些自身能够形成氢键? C2H6, H2O2, C2H5OH, CH3CHO, H3BO3, H2SO4, (CH3)2O 18. 比较两种化合物熔沸点高低,并说明原因。 (1)乙醇(C2H5OH)和二甲醚(CH3OCH3)组成相同,但前者的沸点为78.5℃,而后者的沸点
高中化学选修三第二章分子结构与性质讲义及习题含答案
高中化学选修三第二章分子结构与性质 一、共价键 1.共价键的本质及特征 共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。 2.共价键的类型 ①按成键原子间共用电子对的数目分为单键、双键、三键。 ②按共用电子对是否偏移分为极性键、非极性键。 ③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。 3.键参数 ①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。 ②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。 ③键角:在原子数超过2的分子中,两个共价键之间的夹角。 ④键参数对分子性质的影响:键长越短,键能越大,分子越稳定。 4.等电子原理 原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。 二、分子的空间构型 1.分子构型与杂化轨道理论 杂化轨道的要点:当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。 2.分子构型与价层电子对互斥模型 价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电
子对空间构型,不包括孤对电子。 (1)当中心原子无孤对电子时,两者的构型一致; (2)当中心原子有孤对电子时,两者的构型不一致。 3.配位化合物 (1)配位键与极性键、非极性键的比较 (2)配位化合物 ①定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。 ②组成:如[Ag(NH3)2]OH,中心离子为Ag+,配体为NH3,配位数为2。 三、分子的性质 1.分子间作用力的比较
无机化学第九章 分子结构 练习
第九章 分子结构练习 一、填空题 1. SiF 4中硅原子的轨道杂化方式为______,该分子中的键角为_____;-26SiF 中硅原子的轨道杂化方式为_______,该离子中的键角为_________。 sp 3 '28109 sp 3d 2 90 2. BF 3,NH 3,H 2O ,+4PCl 的键角由大到小的顺序是_____________,中心原子杂 化轨道中不含有孤对电子的有___________。 BF 3>+4PCl >NH 3>H 2O ; BF 3和+4PCl 3. 在C 2H 4分子中,C 和H 间形成______键,C 与C 之间形成______键和______键,碳原子的轨道杂化方式为____________。 σ σ π sp 2 4. 根据分子轨道理论,+2H 、He 2、B 2、C 2、+2 He 、Be 2中,能够存在的有__________,不能存在的有________。 +2 H 、B 2、C 2、+2He ; 2He 、2Be 5.+2O 的分子轨道电子排布式为_________,键级为_________;+2N 的分子轨道电子排布式为__________,呈__________磁性。 ()()()()()()() 1*p 24p 22p 22*s 22s 22*s 12s 1ππσσσσσ 2.5 ()()()()()()12422*2222*121p p s s s s σπσσσσ 顺 6. 根据价层电子对互斥理论,-4ICl 的空间构型为__________,中心原子采用 _______杂化轨道成键;PCl 5(g )的空间构型为_______,中心原子采用_____杂化轨道成键。 平面正方形; sp 3d 2; 三角双锥; sp 3d
第六章 晶体结构与晶体材料
第六章晶体结构与晶体材料 教学目的: 掌握晶体的概念及晶体结构的特点;掌握晶体的宏观对称性;熟悉晶体的基本性质;了解晶体缺陷的重要性。 教学重点: 晶体材料:石英晶体与压电材料、钛酸钡晶体与非线性光学材料、BGO晶体材料。教学难点: 晶体的对称性与晶系。 第一节晶体的结构特点 一、晶体 晶体是由原子或分子按照一定的周期性规律在空间重复排列而成的固体物质。 二、晶体结构的特点 1. 晶体结构的特点 以NaCl晶体为例讨论晶体结构的特点。 NaCl是食盐的主要成分,市售粗盐经过重结晶可得到纯净、漂亮的NaCl晶体。NaCl晶体呈立方体外形,肉眼可以看到平滑的晶面,尖锐的顶角和笔直的棱边。NaCl晶体整齐的外形反映了晶体的内部结构规整性。用X射线衍射法测定的NaCl的晶体结构,如图6-1所示。 2. 晶胞
晶胞晶胞是晶体的一个基本结构单位,它的形状是一个平行六面体。图 6-1给出了NaCl晶体的一个晶胞,无数的这种晶胞在空间规则地重复排列就形成NaCl晶体。 要确定晶体的结构,首先要知道晶胞的大小和形状,其次要知道晶胞中原子的种类、数目和原子的坐标位置。 晶胞的大小和形状由晶胞参数规定。若把晶胞放在坐标系中,如图6-2所示,它的三条棱边a,b,c和三条棱边两两之间的夹角α,β,γ合称为晶胞参数。如NaCl晶体的晶胞参数为:a=b=c=562.8 pm,α=β=γ=90°,这种晶胞称为立方晶胞。NaCl晶体中Na+与Cl-以离子键结合,所以NaCl晶体称为离子晶体。在NaCl晶体中,一个Na+周围配有6个Cl-(配位数为6)。这6个配位Cl-形成一个八面体,Na+处于八面体的空隙中。同样地,以一个Cl-为中心,周围也配有6个Na+,Cl-也处于Na+的八面体空隙中。由此可见,NaCl只是个化学式,整块NaCl 晶体是个巨大的分子,把NaCl看作一个分子(或分子式)是不确切的。 3. 结构基元 结构基元是指晶体中作周期性规律重复排列的那一部分内容。它是晶体中重复排列的基本单位,必须满足化学组成相同、空间结构相同、排列取向相同和周围环境相同的条件。晶胞中含一个结构基元的称为素晶胞,含2个和2个以上结构基元的称复晶胞。图6-1的NaCl晶胞中含4个Na—Cl结构基元,是面心立方型式的复晶胞。图6-3给出了CsCl晶体和金属钨晶体的晶胞结构。CsCl晶胞中只含1个结构基元(Cs—Cl),所以是素晶胞,它是立方晶胞,故称为简单立方。
化学选修三第二章《分子结构与性质》知识点及全套练习题
第二章分子结构与性质 一.共价键 1.共价键的本质及特征 共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。 2.共价键的类型 ①按成键原子间共用电子对的数目分为单键、双键、三键。 ②按共用电子对是否偏移分为极性键、非极性键。 ③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。 3.键参数 ①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。 ②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。 ③键角:在原子数超过2的分子中,两个共价键之间的夹角。 ④键参数对分子性质的影响:键长越短,键能越大,分子越稳定. 4.等电子原理 原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。二.分子的立体构型 1.分子构型与杂化轨道理论 杂化轨道的要点: 当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同。 2.分子构型与价层电子对互斥模型 价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。 (1)当中心原子无孤对电子时,两者的构型一致; (2)当中心原子有孤对电子时,两者的构型不一致。
3.配位化合物 (1)配位键与极性键、非极性键的比较 (2)配位化合物 ①定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。 ②组成:如[Ag(NH3)2]OH,中心离子为Ag+,配体为NH3,配位数为2。 三.分子的性质 1.分子间作用力的比较 2.分子的极性 (1)极性分子:正电中心和负电中心不重合的分子。 (2)非极性分子:正电中心和负电中心重合的分子。 3.溶解性 (1)“相似相溶”规律:非极性溶质一般能溶于非极性溶剂, 极性溶质一般能溶于极性溶剂.若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。 (2)“相似相溶”还适用于分子结构的相似性,如乙醇和水互 溶,而戊醇在水中的溶解度明显减小. 4.手性 具有完全相同的组成和原子排列的一对分子,如左手和右手一样互为镜像,在三维空间里不能重叠的现象。 5.无机含氧酸分子的酸性 无机含氧酸可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,使R—O—H 中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如HClO<HClO2<HClO3<HClO4
人教高中化学选修3第二章分子结构知识点填空带练习教学教材
人教高中化学选修3第二章分子结构知识点填空带练习
第二章分子结构与性质 班级_________ 姓名__________ 【知识网络】 一、共价键 1.概念:__________________________________叫共价键。 2.本质:____________________________________。 3.特点: 按共价键理论可知,一个原子只能与一定数目的原子结合形成分子,这说明共价键具有________性。在多原子的分子中键角一定,这说明共价键具有________性。 4.分类 (1)σ键 ①形成:由成键原子的s原子轨道或p原子轨道“________”重叠而成。 ②类型:形成σ键的能级可以是____与____、____与____、____与____。所以σ键分为三类,分别是________σ键、________σ键、________σ键。 ③特征:以形成化学键的两原子核的________为轴做旋转操作,共价键电子云的图形________,这种特征称为__________。σ键的强度________。 (2)π键 ①形成:由两个原子的p原子轨道“__________”重叠形成。
②特征: π键的电子云具有____________性,即每个π键的电子云由两块组成,分别位于由____________构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为________。π键________旋转,一般不如σ键________,较易________。 5.判断是σ键或是π键的规律 共价________是σ键;共价_______中一个是σ键,另一个是π键;共价_______中一个是σ键,另两个是π键。 二、键参数 1.键能 (1)定义:键能是指____________形成________ mol化学键释放的________能量。 (2)键能与共价键的稳定性之间的关系:化学键的键能越大,化学键________,越不容 易______________。 2.键长 (1)定义:键长是指形成共价键的两个原子之间的________,因此____________决定化 学键的键长,____________越小,共价键的键长越短。 (2)键长与共价键的稳定性之间的关系:共价键的键长越短,往往键能________,3.键角 定义:是指________________________。在多原子分子中键角是一定的,这表明共价键具有________性,因此键角决定着共价分子的__________。 三、等电子原理 1.等电子原理是指__________相同、________________相同的分子具有相似的化学键特征,它们的许多性质(主要是物理性质)是________的。 2.仅第二周期元素组成的共价分子中,为等电子体的是: _____________________________、_____________________________。 四、形形色色的分子 1.三原子分子
第二章 分子结构答案
第二章化学键与分子结构 一、选择题 1.下列分子或离子中,键角最小得就是( ) A、HgCl2 B、H2O C、NH3 D、PH3 2.关于原子轨道得说法正确得就是( ) A、凡中心原子采取sp3杂化轨道成键得分子其几何构型都就是正四面体; B、CH4分子中得sp3杂化轨道就是由4个H原子得1s轨道与C原子得2p轨 道混合起来而形成得; C、sp3杂化轨道就是由同一原子中能量相近得s轨道与p轨道混合起来形成 得一组能量相等得新轨道; D、凡AB3型得共价化合物,其中心原子A均采用sp3杂化轨道成键。 3.下列化合物中氢键最强得就是( ) A、CH3OH B、HF C、H2O D、NH3 4.对羟基苯甲醛比邻羟基苯甲醛得熔沸点高得原因就是( ) A、前者不能形成氢键,后者可以; B、前者能形成氢键,后者不能; C、前者形成分子间氢键,后者形成分子内氢键; D、前者形成分子内氢键,后者形成分子间氢键。 5.下列各组物质沸点高低顺序中正确得就是( ) A、HI>HBr>HCl>HF B、H2Te>H2Se>H2S>H2O C、NH3>AsH3>PH3 D、CH4>GeH4>SiH4 6.I2得CCl4溶液中分子间主要存在得作用力就是( ) A、色散力 B、取向力 C、取向力、诱导力、色散力 D、氢键、诱导力、色散力 7.下列分子中偶极矩为零得就是( ) A、NF3 B、NO2 C、PCl3 D、BCl3 8.下列分子就是极性分子得就是( ) A、BCl3 B、SiCl4 C、CHCl3 D、、BeCl2 9.下列离子或分子有顺磁性得就是( ) A、O2 B、O22- C、N2 D、CO 10.下列分子中心原子就是sp2杂化得就是( ) A、PBr3 B、CH4 C、BF3 D、H2O 11.SO42-离子得空间构型就是( ) A、平面正方形 B、三角锥形 C、四面体 D、八面体 12.下列各物质分子其中心原子以sp2杂化得就是( )
《结构化学》第六章习题
《结构化学》第六章习题 6001 试述正八面体场中,中心离子 d 轨道的分裂方式。 6002 试用分子轨道理论阐明 X -,NH 3 和 CN -的配体场强弱的次序。 6003 按配位场理论,在 O h 场中没有高低自旋络合物之分的组态是:---------------- ( ) (A) d 3 (B) d 4 (C) d 5 (D) d 6 (E) d 7 6004 凡是中心离子电子组态为d 6的八面体络合物,其 LFSE 都是相等的,这一说法是否正确? 6005 络合物的中心离子的 d 轨道在正方形场中,将分裂成几个能级:---------------- ( ) (A) 2 (B) 3 (C) 4 (D) 5 6006 Fe(CN)63-的 LFSE=________________。 6007 凡是在弱场配位体作用下,中心离子 d 电子一定取高自旋态;凡是在强场配位体作用下,中心离子 d 电子一定取低自旋态。这一结论是否正确? 6008 Fe(CN)64-中,CN -是强场配位体,Fe 2+的电子排布为6g 2t ,故 LFSE 为_____________。 6009 尖晶石的一般表示式为 AB 2O 4, 其中氧离子为密堆积,当金属离子A 占据正四面体T d 空隙时,称为正常尖晶石,而当A 占据O h 空隙时,称为反尖晶石, 试从晶体 场稳定化能计算说明 NiAl 2O 4 晶体是什么型尖晶石结构( Ni 2+为d 8结构)。 6010 在 Fe(CN)64-中的 Fe 2+离子半径比 Fe(H 2O)62+中的 Fe 2+离子半径大还是小?为什么? 6011 作图证明 CO 是个强配位体。 6012 CoF 63-的成对能为 21000 cm -1,分裂能为 13000 cm -1 ,试写出: (1) d 电子排布 (2) LFSE 值 (3) 电子自旋角动量 (4) 磁矩 6013 已知 ML 6络合物中(M 3+为d 6),f =1,g = 20000 cm -1,P = 25000 cm -1,它的LFSE 绝对值等于多少?------------------------------------ ( ) (A) 0 (B) 25000 cm -1 (C) 54000 cm -1 (D) 8000 cm -1 6014 四角方锥可认为是正八面体从z 方向拉长,且下端没有配体 L 的情况。试从正八面体场的 d 轨道能级图出发,作出四角方锥体场中的能级分裂图,并简述理由。 6015 某 AB 6n -型络合物属于O h 群,若中心原子 A 的d 电子数为6,试计算配位场稳定 化能,并简单说明你的计算方案的理由。 6016 下列络合物哪些是高自旋的?------------------------------------ ( ) (A) [Co(NH 3)6]3+ (B) [Co(NH 3)6]2+ (C) [Co(CN)6]4- (D) [Co(H 2O)6]3+ 6017 凡是低自旋络合物一定是反磁性物质。这一说法是否正确? 6018 Fe 的原子序数为26,化合物K 3[FeF 6]的磁矩为5.9玻尔磁子,而K 3[Fe(CN)6]的磁矩为1.7玻尔磁子,这种差别的原因是:------------------------------------ ( ) (A) 铁在这两种化合物中有不同的氧化数 (B) CN -离子比 F - 离子引起的配位场分裂能更大 (C) 氟比碳或氮具有更大的电负性 (D) K 3[FeF 6]不是络合物 6019 已知[Fe(CN)6]3-,[FeF 6]3-络离子的磁矩分别为1.7B μ,5.9B μ (B μ为玻尔磁子)( Fe 原子序数26), (1)请分别计算两种络合物中心离子未成对电子数;
